Файл: Сборник лабораторных работ по Учебной дисциплине Физическая Химия Часть 1, часть 2.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 19.03.2024
Просмотров: 554
Скачиваний: 1
СОДЕРЖАНИЕ
Обработка результатов физико-химических измерений
Лабораторная работа № 2. Определение энтальпии диссоциации слабого электролита
Лабораторная работа № 3 Определение изменения энтальпии реакции нейтрализации
Коллигативные свойства растворов
Лабораторная работа № 4. Криометрия
Фазовые равновесия в однокомпонентных системах
Лабораторная работа №5. Давление насыщенного пара
Фазовые равновесия в двухкомпонентных системах
Лабораторная работа №6. Получение кривой разгонки
Лабораторная работа № 7. Получение диаграммы состояния двухкомпонентной неконденсированной системы
Распределение вещества в двухфазной системе. Экстракция
Лабораторная работа № 9. Экстракция цветных металлов нафтеновой кислотой
Электропроводность растворов электролитов
Лабораторная работа №11. Определение чисел переноса ионов
Термодинамика электрохимических систем
Лабораторная работа № 12. Определение стандартных электродных потенциалов
Лабораторная работа № 13. Определение коэффициента активности электролита
Строение вещества. Молекулярные спектры
Лабораторная работа № 17. Исследование кинетики омыления сложного эфира
Поверхностные явления. Сорбция
Лабораторная работа № 18. Исследование поверхности раздела фаз: раствор ПАВ - воздух
Лабораторная работа № 20. Исследование обменной адсорбции ионов
Лабораторная работа № 21. Исследование кинетики ионообменной адсорбции
Лабораторная работа №22. Разделение меди и цинка на катионите
Устойчивость дисперсных систем
Лабораторная работа № 23. Получение лиофобных золей
Лабораторная работа № 24. Определение порога коагуляции визуальным методом
Лабораторная работа № 25. Изучение коагуляции гидрозоля железа
Лабораторная работа № 26. Определение размеров частиц дисперсных систем турбидиметрическим методом
2. Степень извлечения. Представляет собой отношение количества вещества в органической фазе к его общему содержанию в системе.
3. Если при экстракции происходит химическая реакция растворенного вещества с экстрагентом, количественным показателем процесса экстракции, также является константа равновесия процесса экстракции.
Для физико-химической характеристики процесса экстракции следует знать, какие параметры будут влиять на экстракционное равновесие и, как следствие, на величину коэффициента распределения. Например, при экстракции ионов металла Mez+ нафтеновой кислотой HR, не смешивающейся с водой, можно записать такую схему реакции:
При не слишком высоких концентрациях ионов можно считать 1. Тогда константу равновесия можно записать в виде уравнения:
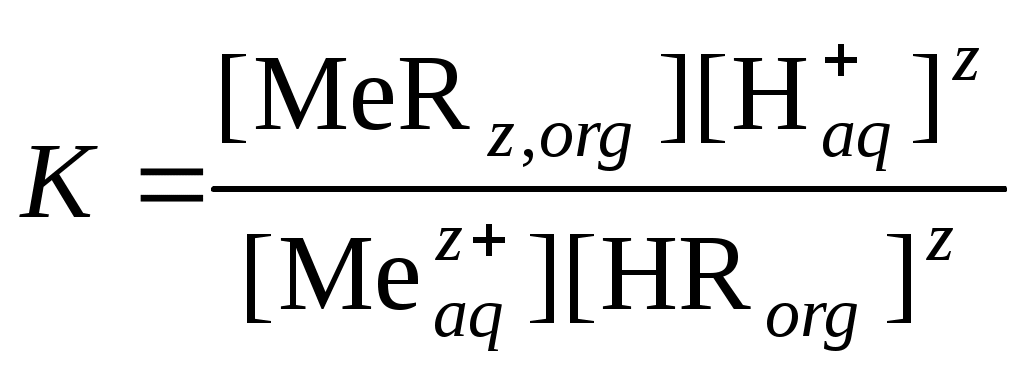 .
.тогда
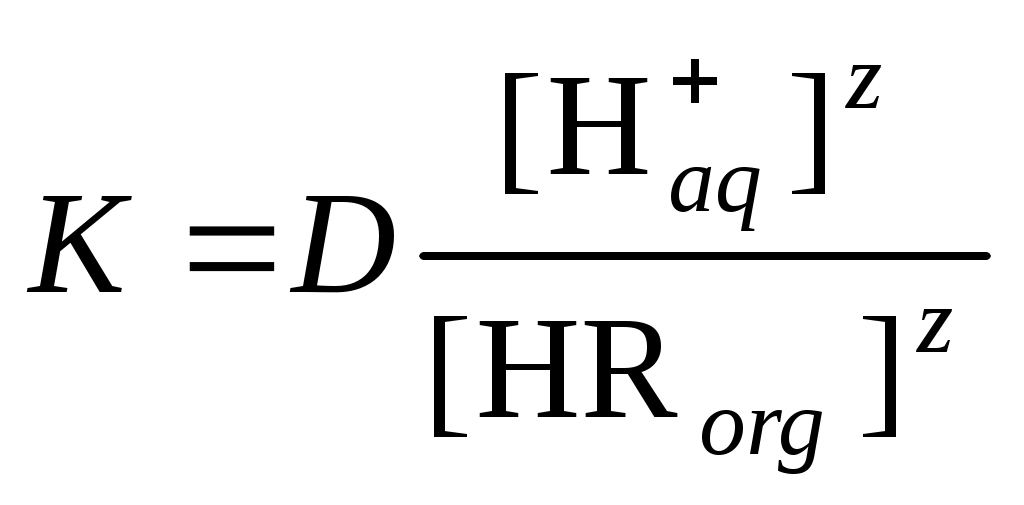 .
. После логарифмирования и небольших преобразований получаем уравнение
которое связывает константу равновесия и коэффициент распределения, а также показывает зависимость коэффициента распределения от концентрации экстрагента и рН.
Получив экспериментальную зависимость коэффициента распределения от, например, рН при постоянной концентрации экстрагента можно определить сольватное число z и константу равновесия процесса экстракции.
Контрольные вопросы
1. В чем сущность процесса экстракции?
2. Чем характеризуется состояние экстракционного равновесия?
3. Что означает «физическое распределение» и «химическое распределение» компонента в экстракционной системе?
4. Какая характеристика вещества лежит в основе физической экстракции?
5. Области применения метода физической экстракции.
6. За счет чего протекает «химическая экстракция»?
7. Чем определяется эффективность процесса химической экстракции?
8. Что представляет собой экстрагент в химической экстракции?
9. Строение химического экстрагента.
10. Основные типы химических экстракционных систем и реакции, лежащие в их основе.
11. Основные количественные характеристики процесса экстракции: коэффициент распределения, степень извлечения, константа равновесия.
12. Взаимосвязь константы равновесия и коэффициента распределения при экстракции карбоновыми кислотами.
13. Как определить сольватное число и константу равновесия на основании экспериментальных данных?
Лабораторная работа № 9. Экстракция цветных металлов нафтеновой кислотой
Цель работы: определить зависимость коэффициента распределения сульфата металла между водным раствором и карбоновой кислотой в зависимости от рН водной фазы.
Сущность работы: по экспериментальной зависимости коэффициента распределения катиона металла между органической и водной фазами от рН определить значение сольватного числа и константу равновесия процесса экстракции.
Оборудование и реактивы. Экстрактор; рН-метр; штатив с кольцами – 1 шт.; стакан химический объемом 200 мл; делительная воронка объемом 250 мл – 4 шт.; воронка – 4 шт.; химические стаканы объемом 50 мл – 8 шт. (для отбора проб – 4 шт., для отбора раствора соли металла – 1 шт., для нафтеновой кислоты – 1 шт., для трилона Б – 1 шт., для хлорида аммония – 1 шт.); мерные цилиндры для экстрагента и раствора соли металла объемом 50 мл – 2 шт.; мерный цилиндр для дозирования хлорида аммония объемом 10 мл – 1 шт.; градуированная пипетка или бюретка объемом 5 мл для дозирования щелочи – 1 шт.; пипетка Мора объемом 10 мл для отбора проб соли металла на титрование – 1 шт.; колбы конические для титрования объемом 250 мл – 2 шт.; бюретка для титрования объемом 25 мл – 1 шт.; гидроксид натрия – 1 н. раствор; Трилон Б – 0,05 М раствор; мурексид; хлорид аммония – 1 М раствор; гидроксид аммония – разбавленный 1:1; растворы сульфатов меди, никеля, кобальта – 0,05 М.
Выполнение работы
1. Настроить блок управления мешалки:
= нажать кнопку «сеть»,
= нажать кнопку «установка» для входа в режим настройки блока управления
= кнопками «выбор» и ▲▼ установить число оборотов (1200) и продолжительность перемешивания (5-10 минут)
= нажать кнопку «установка» для выхода из режима настройки.
2. В стакан для перемешивания внести 30 мл раствора сульфата металла и 15 мл нафтеновой кислоты.
3. Погрузить мешалку в стакан, нажать кнопку «пуск» (должно происходить интенсивное перемешивание содержимого стакана).
4. Добавить по каплям при перемешивании!!! 1 мл раствора гидроксида натрия.
5. После того, как вся щелочь добавлена продолжать перемешивание еще 5 мин. Остановить мешалку (кнопкой «стоп» или она остановится автоматически).
6. Перелить смесь в делительную воронку для расслаивания фаз.
7. Повторить п.п. 2 – 6 изменяя количество добавляемой щелочи: 1,5 мл, 2 мл, 2,5 мл.
8. После того, как органическая фаза отделилась, водную фазу (внизу) через бумажный фильтр слить в химический стаканчик. Органическую фазу вылить в емкость для органических отходов!!!
9. Измерить рН водной фазы на рН-метре для каждой пробы:
= вынуть электрод рН-метра из стаканчика с дистиллированной водой, протереть кусочком фильтра,
= погрузить электрод в исследуемый раствор, следя за тем, чтобы отводка электрода была покрыта жидкостью,
= считать значение рН на табло рН-метра,
= вынуть электрод, протереть кусочком фильтра, сполоснуть дистиллированной водой, вытереть насухо и погрузить в следующий раствор и.т.д.
10. Проанализировать содержание металла в водном растворе (исходный раствор и растворы после экстракции).
Анализ содержания меди (2+)
Отобрать мерной пипеткой в 2 конические колбы аликвоты объемом 10 мл.
Приливать по каплям при перемешивании аммиак до получения ярко-синего раствора аммиаката меди.
Добавить немного сухого индикатора «мурексид».
Титровать раствором трилона Б до перехода окраски индикатора в эквивалентной точке от желто-красной к фиолетовой.
Анализ содержания кобальта и никеля
Отобрать мерной пипеткой в две конические колбы аликвоты объемом 10 мл.
Прилить в каждую колбу по 10 мл хлорида аммония (с помощью мерного цилиндра) и дистиллированную воду до объема 40-50 мл.
Добавить немного сухого индикатора «мурексид».
Титровать раствором трилона Б до переход окраски индикатора в эквивалентной точке от желтой к фиолетовой.
Примечание: желтую окраску раствора в ходе титрования поддерживают добавлением NH4OH, т.е., если в ходе титрования раствор краснеет, то следует добавить несколько капель аммиака и он снова станет желтым.
10. Результаты эксперимента (рН и результаты титрования) занести в таблицу.
Содержание протокола лабораторной работы
Название экстрагента:
Концентрация экстрагента:
Растворитель:
Название соли металла:
Химическая формула соли металла:
Концентрация раствора щелочи (NaOH)
СNaOH = _________
Концентрация раствора трилона Б СТ = ___________
Объем аликвоты, взятый для анализа Vа = _______мл.
Таблица экспериментальных данных
| № п/п | VNaOH, мл | рН | V трилона Б, мл | |
| V1 | V2 | |||
| исходный | нет | нет | | |
| 1 | 1,0 | | | |
| 2 | 1,5 | | | |
| 3 | 2,0 | | | |
| 4 | 2,5 | | | |
Обработка результатов эксперимента
1. Рассчитать исходную и равновесные концентрации металла (2+) по уравнению:
где VT и СТ – объем, мл и концентрация, моль/л трилона Б, Va – объем аликвоты, мл.
2. Вычислить концентрацию металла (2+) в органической фазе по уравнению:
где
3. Рассчитать коэффициент распределения
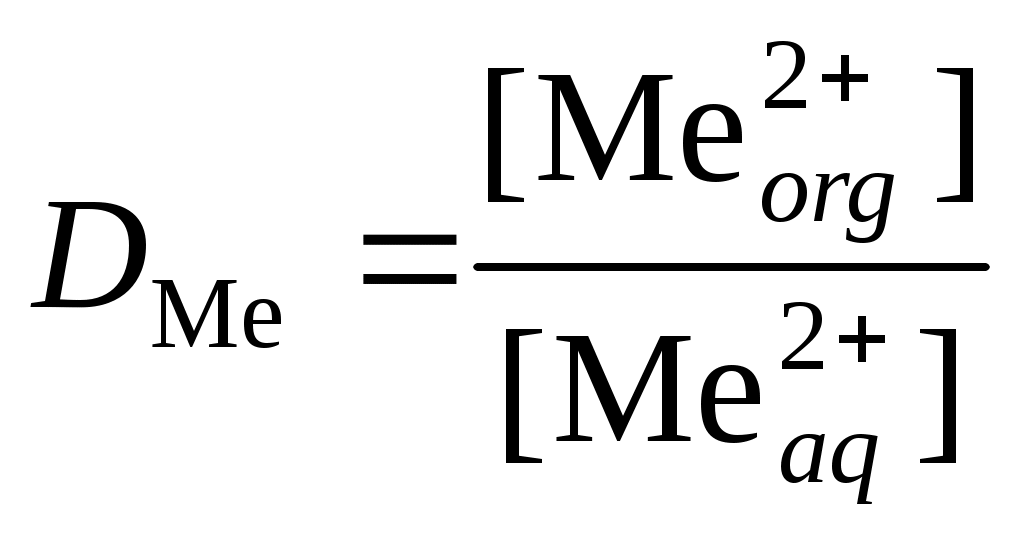 .
.4. Заполнить таблицу:
| № п/п | VNaOH, мл | рН | VТрБ, мл (средний по двум измерениям) | | | DMe | lgDMe |
| | | | | | | | |
| | | | | | | | |
| | | | | | | | |
