Файл: Сборник лабораторных работ по Учебной дисциплине Физическая Химия Часть 1, часть 2.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 19.03.2024
Просмотров: 541
Скачиваний: 1
СОДЕРЖАНИЕ
Обработка результатов физико-химических измерений
Лабораторная работа № 2. Определение энтальпии диссоциации слабого электролита
Лабораторная работа № 3 Определение изменения энтальпии реакции нейтрализации
Коллигативные свойства растворов
Лабораторная работа № 4. Криометрия
Фазовые равновесия в однокомпонентных системах
Лабораторная работа №5. Давление насыщенного пара
Фазовые равновесия в двухкомпонентных системах
Лабораторная работа №6. Получение кривой разгонки
Лабораторная работа № 7. Получение диаграммы состояния двухкомпонентной неконденсированной системы
Распределение вещества в двухфазной системе. Экстракция
Лабораторная работа № 9. Экстракция цветных металлов нафтеновой кислотой
Электропроводность растворов электролитов
Лабораторная работа №11. Определение чисел переноса ионов
Термодинамика электрохимических систем
Лабораторная работа № 12. Определение стандартных электродных потенциалов
Лабораторная работа № 13. Определение коэффициента активности электролита
Строение вещества. Молекулярные спектры
Лабораторная работа № 17. Исследование кинетики омыления сложного эфира
Поверхностные явления. Сорбция
Лабораторная работа № 18. Исследование поверхности раздела фаз: раствор ПАВ - воздух
Лабораторная работа № 20. Исследование обменной адсорбции ионов
Лабораторная работа № 21. Исследование кинетики ионообменной адсорбции
Лабораторная работа №22. Разделение меди и цинка на катионите
Устойчивость дисперсных систем
Лабораторная работа № 23. Получение лиофобных золей
Лабораторная работа № 24. Определение порога коагуляции визуальным методом
Лабораторная работа № 25. Изучение коагуляции гидрозоля железа
Лабораторная работа № 26. Определение размеров частиц дисперсных систем турбидиметрическим методом
Примером электрода второго рода может служить хлорсеребряный электрод, Ag, AgCl|KCl, потенциал которого зависит от содержания ионов Cl в растворе. Хлорсеребряный электрод нередко используют в качестве электрода сравнения при потенциометрических измерениях. В этом случае приэлектродное пространство заполняют насыщенным раствором хлорида калия, что обеспечивает стабильность значения электродного потенциала.
Газовые электроды состоят из инертного металла (Pt), контактирующего с газом и с раствором, содержащим одноименные с газом ионы. Самый известный пример газового электрода – водородный электрод: H+|H2, Pt. Для этого электрода реализуется реакция: H+ + e 1/2H2, для которой уравнение Нернста:
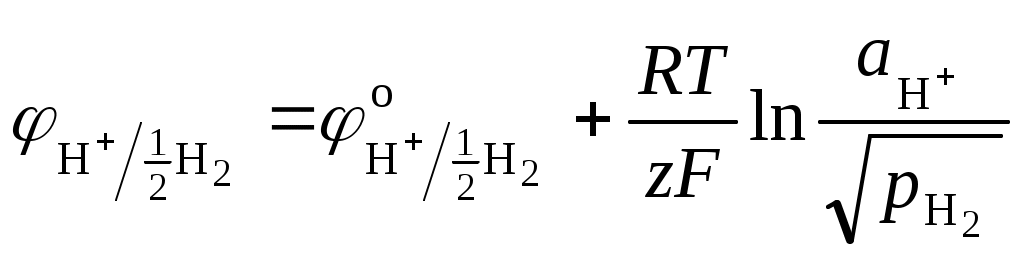 или
или Окислительно-восстановительные электроды. Такая система состоит из компонентов, находящихся в растворе. В этом случае индикаторным электродом служит инертный металл (обычно платина или золото), который не принимает участия в реакции, а служит лишь передатчиком электронов между компонентами окислительно-восстановительной системы, поэтому только последние определяют величину потенциала электрода. Примером может служить платина, погруженная в раствор, содержащий Fe2+ и Fe3+. В этом случае на электроде протекает реакция Fe3+ + е = Fe2+, потенциал которой будет определяться уравнением:
Два электрода, соединенных друг с другом посредством электролитического ключа или каким-либо другим проводником, представляют собой электрохимическую цепь. Для записи формул цепей существуют определенные правила. Сева располагается электрод, имеющий более отрицательный потенциал (анод), а справа – менее отрицательный (катод). На катоде идет процесс восстановления:
, на аноде идет процесс окисления:
Растворы обоих электродов отделяются вертикальной пунктирной линией, если они контактируют друг с другом:
Электрической характеристикой электрохимической цепи является электродвижущая сила. ЭДС гальванического элемента определяется по формуле:
Е = К – А или Е = ox red,
где К и А – потенциалы катода и анода; ox – электрохимический потенциал «окислителя», более положительного электрода, red – электрохимический потенциал «восстановителя», более отрицательного электрода.
Электрохимическая цепь может быть составлена из разных электродов или из одинаковых электродов. В последнем случае, так как потенциал электрода зависит от концентрации, ЭДС гальванического элемента, составленных из однотипных электродов (один и тот же металл в растворе одной и той же соли) с разными концентрациями растворов, будет отличен от нуля. Такой гальванический элемент называется концентрационным. Анодом в нем является электрод с меньшей концентрацией потенциалопределяющих ионов.
Разность электрохимических потенциалов определяет направление протекания процесса:
G = −zFE,
где G – энергия Гиббса электрохимической реакции, z – число электронов, принимающих участие в окислительно-восстановительном процессе, F – число Фарадея, Е – разность потенциалов.
Приближенно направление электрохимического процесса вообще, можно оценить по значению стандартных электрохимических потенциалов.
Группа методов анализа, основанная на измерении ЭДС электрохимических систем получила название потенциометрический анализ или потенциометрия. Существуют два основных варианта проведения потенциометрического анализа растворов: метод прямой потенциометрии и потенциометрическое титрование.
Метод прямой потенциометрии, помимо установления концентрации определяемого вещества в растворе, позволяет определить такие важные физико-химические величины, как значение стандартного электродного потенциала, средний ионный коэффициент активности электролита, константу диссоциации слабого электролита, растворимость малорастворимого соединения и т.д. Особенно важно, что потенциометрические методы можно применять для изучения процессов в неводных средах. В настоящее время все большее
применение получают мембранные электроды, которые представляют собой тонкую мембрану, способную обмениваться с раствором ионами. Вследствие такого обмена на границе «мембрана – раствор» устанавливается потенциал, зависящий от концентрации обмениваемых ионов в растворе.
В качестве электродов сравнения при потенциометрических определениях наиболее часто используют хлорсеребряный или каломельный электроды. Электроды сравнения, если это допустимо, погружают непосредственно в исследуемый раствор или соединяют с ним посредством электролитического мостика – стеклянной U-образной трубки, наполненной электролитом (чаще всего хлоридом или нитратом калия).
Контрольные вопросы
1. Какие процессы относят к электрохимическим?
2. Что такое двойной электрический слой?
3. Какими способами может образовываться ДЭС?
4. Что такое стандартный водородный электрод?
5. От каких параметров системы зависит величина электрохимического потенциала?
6. Каким уравнением описывается зависимость электрохимического потенциала от параметров состояния электрохимической системы?
7. Что такое электрод 1 рода? Как выглядит уравнение Нернста для электрода 1 рода применительно к свинцовому электроду?
8. Что такое электрод 2 рода? Уравнение Нернста для хлорсеребряного электрода.
9. Приведите определение газового электрода.
10. Составьте уравнение Нернста для окислительно-восстановительного электрода?
11. Перечислите правила записи формулы электрода.
12. Правила записи формулы гальванического элемента.
13. Что такое катод и анод?
15. Как вычисляется ЭДС гальванического элемента?
16. Как связаны ЭДС и энергия Гиббса?
17. Какой электрод используется в потенциометрии в качестве электрода сравнения?
Лабораторная работа № 12. Определение стандартных электродных потенциалов
Цель работы: определить стандартный электродный потенциал металлического электрода.
Сущность работы: стандартный электродный потенциал вычисляют по уравнению Нернста по данным ЭДС, и данных о значении и о электрода сравнения. Полученный результат сопоставляют со справочными данными.
Оборудование и реактивы. Потенциометр (иономер); электроды: медный, цинковый и свинцовый; хлорсеребряный электрод сравнения; химический толстостенный стакан объемом 75 мл – 4 шт. (для солей цинка, свинца, меди и насыщенного раствора нитрата калия); химический стакан объемом 50 мл – 5 шт. (для разбавленных растворов соли металла); мерные колбы объемом 100 мл – 5 шт. (для приготовления разбавленных растворов соли металла); пипетка Мора объемом 50 мл; электролитический мост, заполненный насыщенным раствором нитрата калия; сульфат меди – раствор концентрацией 0,5 моль/кг; сульфат никеля, 0,5 н. раствор; нитрат свинца, 0,5 н. раствор; хлорид калия – насыщенный раствор; нитрат калия – насыщенный раствор; наждачная бумага.
Выполнение работы
Вариант 1
1. Наждачной бумагой тщательно зачистить металлические электроды: медный, цинковый или свинцовый (по указанию преподавателя);
2. Из исходного раствора по заданию преподавателя путем разбавления приготовить растворы следующих рекомендуемых концентраций 0,2; 0,1; 0,05; 0,02; или 0,01 моль/кг.
3. Собрать схему:
Если стрелка амперметра блока чувствительности отклонилась в отрицательную сторону, то этот факт отметить и поменять местами клеммы электродов. В этом случае значение Еизм < 0.
4. Измерить с помощью потенциометра с точностью до 0,1 мВ электродвижущую силу элемента Еизм.
А) установить переключатель чувствительности в положение «1».
Б) первую слева ручку магазина сопротивлений поворачивать вправо до того момента, когда стрелка амперметра блока чувствительности покажет «0».
В) установить переключатель чувствительности в положение «2».
Г) вторую слева ручку магазина сопротивлений (верхний ряд) поворачивать вправо до того момента, когда стрелка амперметра блока чувствительности покажет «0».
Д) повторить для положений чувствительности «3» и «4», каждый раз выводя стрелку на «0».
Е) в окошках магазина сопротивлений считать значение ЭДС, мВ.
5. Значение Еизм занести в таблицу экспериментальных данных.
Вариант 2
1. В маркированный химический стакан объемом 75 мл отобрать раствор сульфата меди, сульфата цинка или нитрата свинца (по заданию преподавателя).
2. Из исходного раствора соли металла приготовить 5 последовательно разбавленных в два раза растворов. В мерную колбу № 1 объемом 100 мл отобрать из маркированного стаканчика 50 мл раствора, довести объем жидкости в колбе до метки дистиллированной водой, закрыть колбу пробкой и перемешать, переворачивая колбу не менее 40 раз. Из мерной колбы № 1 в мерную колбу объемом 100 мл № 2 отобрать мерной пипеткой 50 мл приготовленного раствора, довести объем жидкости в колбе до метки дистиллированной водой, закрыть колбу пробкой и перемешать, переворачивая колбу не менее 40 раз. Из мерной колбы № 2 в мерную колбу объемом 100 мл № 3 отобрать мерной пипеткой 50 мл приготовленного раствора, довести объем жидкости в колбе до метки дистиллированной водой, закрыть колбу пробкой и перемешать, переворачивая колбу не менее 40 раз и.т.п.
3. Кусочком наждачной бумаги тщательно зачистить металлический электрод: медный, цинковый или свинцовый.
4. Отобрать приготовленные растворы в маркированные химические стаканы объемом 50 мл.
5. В отдельный маркированный химический стакан объемом 50 мл отобрать насыщенный раствор нитрата калия.
6. Погрузить зачищенный металлический электрод в раствор соли металла концентрацией 0,01 моль/кг.
7. В стакан с насыщенным раствором нитрата калия поместить хлорсеребряный электрод.
8. Подключить иономер к электрический сети и нажать кнопку «вкл.»
9. К клемме «изм.» иономера присоединить металлический электрод, к клемме «вспом.» - хлорсеребряный электрод.
10. Замкнуть электрохимическую цепь при помощи электролитического мостика – П-образной стеклянной трубки, заполненной насыщенным раствором нитрата калия.
11. На табло прибора прочитать значение ЭДС, которое занести в таблицу экспериментальных данных.
