ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 139
Скачиваний: 0
СОДЕРЖАНИЕ
Сборник методических указаний к лабораторным работам
Сущность и основы метода ик-спектроскопии
3.4. Определение железа (III) в водных растворах методом градуировочного графика.
3.3. Определение титана (IV) методом градуировочного графика.
3.4. Определение фосфора в водных растворах методом градуировочного графика.
3.5. Определение нитрит-ионов методом градуировочного графика.
1.3. Рефрактометрическое определение сахара в молоке
1. Иономер-кондуктометр; 2. Магнитная мешалка; 3. Кондуктометрический датчик; 4. Ячейка; 5. Бюретка
-
Определение ионов и в их смеси методом кондуктометрического титрования
Уравнения титрования соли
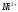 и
и
 в молекулярном, полном и сокращенной
ионном виде:
в молекулярном, полном и сокращенной
ионном виде:
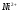 +H2Y2-
+H2Y2-
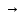 …
…
Ca2++
H2Y2-
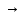 …
…
Факторы эквивалентности.
Законы эквивалентности.
Ход работы.
Результаты титрования соли
 и
и
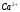 в водном растворе.
в водном растворе.
Таблица 14.7.
|
№ точки |
Объем раствора титранта, V см3 |
Удельная электропроводность æ1, См/см |
Удельная электропроводность æ2, См/см |
Удельная электропроводность æ3, См/см |
|
|
|
|
|
|
Построение кривых титрования в
координатах
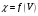 .
Апроксимация зависимости уравнением
линейной регрессии и нахождение объема
титранта в точках эквивалентности.
.
Апроксимация зависимости уравнением
линейной регрессии и нахождение объема
титранта в точках эквивалентности.
4. Расчёт результатов определения соли
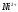 и
и
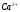 (точность расчётов – 4 значащих цифры,
для массы 0,0001 г). Привести расчётные
формулы и расчёты, рассчитанные значения
занести в таблицы
14.9.
(точность расчётов – 4 значащих цифры,
для массы 0,0001 г). Привести расчётные
формулы и расчёты, рассчитанные значения
занести в таблицы
14.9.
Результаты определения модельной смеси
соли
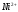 и
и
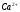
Таблица 14.9.
|
с(1/1Ni2+), моль/дм3 |
T(Ni2+), г/см3 |
n(1/1Ni2+), моль |
ν(Ni2+), моль |
m(Ni2+), г |
|
|
|
|
|
|
|
с(1/1NiCl), моль/дм3 |
T(NiCl), г/см3 |
n(1/1NiCl), моль |
ν(NiCl), моль |
m(NiCl), г |
|
|
|
|
|
|
|
с(1/1Ca2+), моль/дм3 |
T(Ca2+), г/см3 |
n(1/1Ca2+), моль |
ν(Ca2+), моль |
m(Ca2+), г |
|
|
|
|
|
|
|
с(1/1CaCl2), моль/дм3 |
T(CaCl2), г/см3 |
n(1/1CaCl2), моль |
ν(CaCl2), моль |
m(CaCl2), г |
|
|
|
|
|
|
5. Расчёт относительной погрешности:
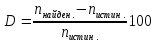
-
Определение сульфат ионов методом кондуктометрического титрования
Уравнения титрования Na2SO4 в молекулярном, полном и сокращенной ионном виде:
Na2SO4
+BaCl2
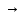 …
…
Факторы эквивалентности.
Законы эквивалентности.
Ход работы.
Результаты титрования Na2SO4 в водном растворе.
Таблица 14.10.
|
№ точки |
Объем раствора титранта, V см3 |
Удельная электропроводность æ1, См/см |
Удельная электропроводность æ2, См/см |
Удельная электропроводность æ3, См/см |
|
|
|
|
|
|
Построение кривых титрования в координатах
 .
Апроксимация зависимости уравнением
линейной регрессии и нахождение объема
титранта в точках эквивалентности.
.
Апроксимация зависимости уравнением
линейной регрессии и нахождение объема
титранта в точках эквивалентности.
4. Расчёт результатов определения Na2SO4 (точность расчётов – 4 значащих цифры, для массы 0,0001 г). Привести расчётные формулы и расчёты, рассчитанные значения занести в таблицы 14.11.
Результаты определения Na2SO4
Таблица 14.11.
|
с(1/1 SO42-), моль/дм3 |
T(SO42-), г/см3 |
n(1/1 SO42-), моль |
ν(SO42-), моль |
m(SO42-), г |
|
|
|
|
|
|
|
с(1/1 Na2SO4), моль/дм3 |
T(Na2SO4), г/см3 |
n(1/1 Na2SO4), моль |
ν(Na2SO4) моль |
m(Na2SO4), г |
|
|
|
|
|
|
5. Расчёт относительной погрешности:

-
Вопросы для самоконтроля.
В чем различие прямой и косвенной кондуктометрии? Какой метод более селективен? Почему?
В каком современнном методе анализа используют кондуктометрические детекторы?
Электропроводность раствора азотной кислоты, как показали соответствующие измерения, составляет 0,02273 см. Константа ячейки, в которой проводили измерения, была определена в специальном эксперименте. Рассчитайте концентрацию азотной кислоты в растворе, если константа ячейки равна 0,0053 м-1.
Растворимость
 в воде при
в воде при
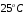 и давлении
и давлении
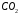 1 атм составляет 1,45 г/дм3. Используя
соответствующие величины предельной
подвижности ионов и удельной
электропроводности воды, находящейся
в равновесии с воздухом, рассчитайте
степень диссоциации диоксида углерода
в воде при
1 атм составляет 1,45 г/дм3. Используя
соответствующие величины предельной
подвижности ионов и удельной
электропроводности воды, находящейся
в равновесии с воздухом, рассчитайте
степень диссоциации диоксида углерода
в воде при
 .
Мольная доля
.
Мольная доля
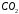 в сухом воздухе равна 0,000314.
в сухом воздухе равна 0,000314.
Кондуктометрическое титрование 10 см3
0,01 моль/дм3 раствора
 проводилось 0,01 моль/дм3 стандартным
водным раствором
проводилось 0,01 моль/дм3 стандартным
водным раствором
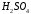 .
Рассчитайте удельную электропроводность
раствора а) перед началом титрования
до добавления серной кислоты, б) в точке
эквивалентности и в) после добавления
к раствору
.
Рассчитайте удельную электропроводность
раствора а) перед началом титрования
до добавления серной кислоты, б) в точке
эквивалентности и в) после добавления
к раствору
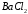 вдвое большего по сравнению с
стехиометрическим количеством
вдвое большего по сравнению с
стехиометрическим количеством
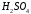 .
Суммарным ионным эффектом можно
пренебречь. Обсудите, насколько
целесообразно такое титрование.
.
Суммарным ионным эффектом можно
пренебречь. Обсудите, насколько
целесообразно такое титрование.
Произведение растворимости сульфата
свинца (II) равно приблизительно
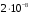 моль2/дм6 . Рассчитайте
удельную электропроводность насыщенного
раствора сульфата свинца (II),
полагая, что при нейтральном рН ионы
существуют в растворе в виде простых
ионов.
моль2/дм6 . Рассчитайте
удельную электропроводность насыщенного
раствора сульфата свинца (II),
полагая, что при нейтральном рН ионы
существуют в растворе в виде простых
ионов.
-
Потенциометрия
-
Цель и задачи работы
-
Изучение возможностей и аппаратурного оформления прямой потенциометрии и овладение приемами практического применения потенциометрического титрования.
-
Оборудование и реактивы
1. Установка для потенциометрического титрования (рис. 12.1)
2. Иономер универсальный Анион-4100.
3. Цилинд вместимостью 100 см3.
4. Стеклянный и хлорсеребряный электроды.
5. Магнитная мешалка.
6. Химический стакан объемом 50, 100 см3.
7. Коническая колба объемом 250 см3.
8. Пипетка объемом 10 см3.
9. Бюретка объемом 25 см3.
10. Мерная колба объемом 100 см3.
11. Гидроксид натрия, водный раствор
 = 0,1 моль/дм3.
= 0,1 моль/дм3.
12. Соляная кислота, водный раствор
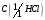 = 1 моль/дм3.
= 1 моль/дм3.
13. Соляная кислота, водный раствор
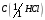 = 0,1 моль/дм3 (стандартный раствор).
= 0,1 моль/дм3 (стандартный раствор).
14. Уксусная кислота, раствор
 = 1 моль/дм3.
= 1 моль/дм3.
15. Ацетон.
16. Индикатор метиловый оранжевый, водный раствор с массовой долей 0,1%.
17. Платиновый электрод.
18. Серная кислота, раствор
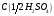 = 1 моль/дм3.
= 1 моль/дм3.
19. Бихромат калия, стандартный раствор
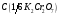 =0,01моль/дм3.
=0,01моль/дм3.
20. Сульфат железа (II), раствор
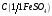 = 0,1 моль/дм3 (готовится перед
анализом).
= 0,1 моль/дм3 (готовится перед
анализом).
21. Хлорид железа (III), раствор
 = 0,3 моль/дм3 .
= 0,3 моль/дм3 .
22. Хлорид олова, раствор
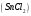 = 1% масс. в растворе хлороводородной
кислоты
= 1% масс. в растворе хлороводородной
кислоты
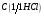 = 1 моль/л.
= 1 моль/л.
23. Гексоцианоферрат (III) калия, 1%-ный раствор.
24. Гексоцианоферрат (II) калия, стандартный раствор c(1/2 K4Fe(CN)6) = 0,1000 моль/дм3 раствор.
25. Нитрат свинца, c(1/1 Pb(NO3)2) = 0,1000 моль/дм3 раствор.
26. ЭТДА, стандартный раствор c(1/1 ЭДТА) = 0,0500 моль/дм3.
27. Ацетат аммония, 25%-ый раствор.
28. Cоль Мора , 0,01 М раствор.
29. Хлорид железа (III), c(1/1 FeCl3) = 0,0500 моль/дм3 .
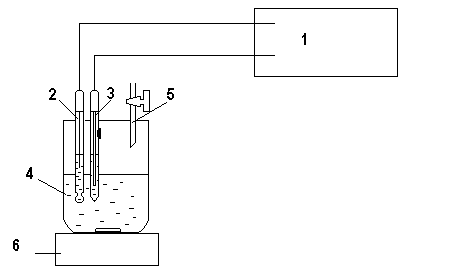
Рис 12.1. Схема установки для потенциометрического титрования:


