ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 147
Скачиваний: 0
СОДЕРЖАНИЕ
Сборник методических указаний к лабораторным работам
Сущность и основы метода ик-спектроскопии
3.4. Определение железа (III) в водных растворах методом градуировочного графика.
3.3. Определение титана (IV) методом градуировочного графика.
3.4. Определение фосфора в водных растворах методом градуировочного графика.
3.5. Определение нитрит-ионов методом градуировочного графика.
1.3. Рефрактометрическое определение сахара в молоке
1. Иономер-кондуктометр; 2. Магнитная мешалка; 3. Кондуктометрический датчик; 4. Ячейка; 5. Бюретка
2. Проводят ориентировочное и точное титрование раствором NaOH с точным титром до 15,0 см3 титранта, обнаруживая два скачка потенциала (первый - небольшой, второй - основной). Результаты записывают в таблицы 12.3 (ориентировочное титрование) и 12.4 (точное титрование).
4. По результатам точного титрования в водном растворе строят кривые титрования в координатах pH - f(V) и ΔpH/ΔV = f(V).
7. Рассчитывают содержание и концентрацию фосфорной кислоты и дигидрофосфата натрия по известным формулам.
-
Определение железа (II) в присутствии железа (III) методом потенциометрического титрования.
Метод основан на потенциометрическом
титровании ионов
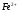 раствором бихромата калия в сернокислой
среде с индикаторным платиновым
электродом и хлорсеребряным электродом
сравнения. При титровании протекает
следующая реакция:
раствором бихромата калия в сернокислой
среде с индикаторным платиновым
электродом и хлорсеребряным электродом
сравнения. При титровании протекает
следующая реакция:
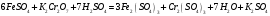
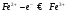
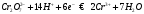
Ход работы.
-
Приготовление модельного раствора
Для приготовления модельного раствора аликвотную часть 5,0 см3 стандартного раствора сульфата железа (II) переносят с помощью пипетки в мерную колбу вместимостью 100 см3, прибавляют 5,0 см3 хлорида железа (III), 10,0 см3 раствора серной кислоты и доводят до метки дистиллированной водой.
-
Определение содержания железа (II) в анализируемом растворе
1. В ячейку титрования отбирают пипеткой 10 см3 модельного раствора, приливают 10 см3 раствора серной кислоты. В полученный раствор помещают платиновый и хлоридсеребрянный электроды.
2. Проводят ориентировочное и точное титрование анализируемого раствора стандартным раствором бихромата калия по пункту 12.2.1.1. По достижении скачка потенциалов титрование продолжают до тех пор, пока изменение ЭДС будет незначительно (до объема титранта 10,0 см3).
3.Титрование повторяют 2 раза. Результаты заносят в таблицы 12.7(ориентировочное титрование) и 12.8. (точное титрование).
4. По результатам точного титрования
строят кривые титрования в координатах
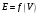 и
и
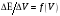 .
.
5. Находят среднее значение объема раствора бихромата калия, израсходованного на титрование сульфата железа (II), и рассчитывают содержание и концентрацию железа (II) и сульфата железа (II) по известным формулам.
-
Определение свинца (II) в растворе.
Смесь ионов гексацианоферрата (II) и гексацианоферрата (III) , представляющая собой обратимую окислительно-восстановительную систему, является потенциалопределяющей в случае использования инертного электрода (обычного платинового).
Ионы свинца образуют малорастворимые соединения Pb3[Fe(CN)6]2 и Pb2[Fe(CN)6]. Поэтому, если до титрования в испытуемый раствор прибавить немного раствора соли K3Fe(CN)6 , то возможно образование Pb3[Fe(CN)6]2 .
При прибавлении титрованного раствора K4Fe(CN)6 иона свинца переходят в менее растворимое соединение – гексацианоферрат (II) свинца. Поэтому в начале титрования потенциал электрода несколько возрастает за счет увеличения концентрации Fe(CN)63-, а затем уменьшается.
-
Контрольная задача. Определение свинца (II) в растворе.
1.В ячейку для титрования отбирают пипеткой 5,0 см3 модельного раствора, добавляют 10,0 см3 раствора уксусной кислоты, 1,0 см3 раствора гексацианоферрата (III) калия и помещают платиновый и хлоридсеребрянный электроды.
2. Проводят ориентировочное и точное титрование анализируемого раствора стандартным раствором гексацианоферрата (II) калия по пункту 12.2.1.1. По достижении скачка потенциалов титрование продолжают до тех пор, пока изменение ЭДС будет незначительно (до объема титранта 10,0 см3).
3.Титрование повторяют 2 раза. Результаты заносят в таблицы 12.10 (ориентировочное титрование) и 12.11. (точное титрование).
4. По результатам точного титрования
строят кривые титрования в координатах
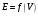 и
и
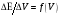 .
.
5. Содержание и концентрац3ию свинца в модельном растворе рассчитывают с учетом состава образующегося при титровании осадка Pb2[Fe(CN)6] по известным формулам.
-
Определение железа (III) в растворе
Метод основан на том, что устойчивость комплексов ЭДТА с окисленной (βFeY- = 1,3 · 1025 ) и восстановленной (βFeY2- = 2,1 · 1014 ) форма сильно различается. Так, можно оттитровать раствор, содержащий ионы железа (III), проследив за изменением потенциалов платинового электрода, погруженного в испытуемый раствор.
Титрование модно проводить достаточно
в широком интервале pH, в
присутствии потенциометрического
индикатора – ионов железа (II). в кислых
растворах (pH
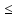 3) образование комплеса Fe3+
замедляется, что отражается на
скорости установления равновесного
потенциала.
3) образование комплеса Fe3+
замедляется, что отражается на
скорости установления равновесного
потенциала.
-
Определение железа (III) в растворе (рабочий электрод – платиновый)
1. В ячейку для титрования отбирают пипеткой 5,0 см3 модельного раствора, добавляют 2,0 см3 раствора ацетата аммиония и 1,0 см3 раствора соли Мора, 20,0 см3 дистиллированной воды, а затем помещают в раствор платиновый и хлоридсеребрянный электроды.
2. Проводят ориентировочное и точное титрование анализируемого раствора стандартным раствором ЭДТА по пункту 12.2.1.1. По достижении скачка потенциалов титрование продолжают до тех пор, пока изменение ЭДС будет незначительно (до объема титранта 10,0 см3).
3.Точное титрование повторяют 2 раза. Результаты заносят в таблицы 12.13 (ориентировочное титрование) и 12.14. (точное титрование).
4. По результатам точного титрования
строят кривые титрования в координатах
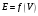 и
и
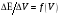 .
.
5. Рассчитывают содержание и концентрацию железа (III) и хлорида железа (III) по известным формулам.
-
Определение железа (III) в растворе (рабочий электрод – стеклянный)
1. В ячейку для титрования отбирают пипеткой 5,0 см3 модельного раствора, добавляют 2,0 см3 раствора ацетата аммиония и 1,0 см3 раствора соли Мора, 20,0 см3 дистиллированной воды, а затем помещают в раствор стеклянный и хлоридсеребрянный электроды.
2. Проводят ориентировочное и точное титрование анализируемого раствора стандартным раствором ЭДТА по пункту 12.2.1.1. По достижении скачка потенциалов титрование продолжают до тех пор, пока изменение рН будет незначительно (до объема титранта 10,0 см3).
3.Точное титрование повторяют 2 раза. Результаты заносят в таблицы 12.15 (ориентировочное титрование) и 12.16. (точное титрование).
4. По результатам точного титрования строят кривые титрования в координатах и рН=f(V) и ΔpH/ΔV=f(V)
5. Рассчитывают содержание и концентрацию железа (III) и хлорида железа (III) по известным формулам.
-
Оформление лабораторного журнала
-
Определение нитрат-ионов методом прямой потенциометрии методом градуировочного графика и методом добавок
-
1. Цель и задачи работы.
2. Ход определения.
2.1. Работа с прибором
2.2. Приготовление стандартных растворов
2.3. Построение градуировочного графика для нитрат-селективного электрода
Данные для построения градуировочного графика калибровки электрода в координатах Е=f(рNO3)
Таблица
|
рNO3 |
Потенциал Е, мВ |
|
|
Е1 |
Е2 |
|
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
4 |
|
|


