ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 141
Скачиваний: 0
СОДЕРЖАНИЕ
Сборник методических указаний к лабораторным работам
Сущность и основы метода ик-спектроскопии
3.4. Определение железа (III) в водных растворах методом градуировочного графика.
3.3. Определение титана (IV) методом градуировочного графика.
3.4. Определение фосфора в водных растворах методом градуировочного графика.
3.5. Определение нитрит-ионов методом градуировочного графика.
1.3. Рефрактометрическое определение сахара в молоке
1. Иономер-кондуктометр; 2. Магнитная мешалка; 3. Кондуктометрический датчик; 4. Ячейка; 5. Бюретка
1. Иономер универсальный Анион-4100. 2. Стеклянный электрод. 3. Хлорсеребряный электрод. 4.Ячейка. 5. Бюретка. 6. Магнитная мешалка.
-
Определение нитрат-ионов методом прямой потенциометрии методом градуировочного графика и методом добавок
Ионометрический метод основан на извлечении нитратов раствором алюмокалиевых квасцов или дистиллированной водой с последующим измерением концентрации нитратов с помощью ионселективного нитратного электрода.
Метод добавок в ионометрии основан на сравнении потенциалов исследуемого раствора и растворов, которые содержат исследуемый раствор и добавку известного количества исследуемого вещества.
Ход работы
-
Работа с прибором
Индикаторный электрод и электрод сравнения поместить в потенциометрическую ячейку со стандартным раствором и подключить к иономеру. Включить иономер в режим измерения потенциала.
-
Приготовление стандартных растворов.
Для приготовления раствора с концентрацией: 0,01 моль/дм3 - переносят в мерную колбу (колба 2) вместимостью 100 см3 10 см3 рабочего раствора (колба 1); 0,001 моль/дм3 - переносят в мерную колбу (колба 3) вместимостью 100 см3 10 см3 раствора из колбы 2; 0,0001 моль/дм3 - переносят в мерную колбу (колба 4) вместимостью 100 см3 10 см3 раствора из колбы 3.
-
Градуировка электрода
Для проведения калибровки электрода готовят серию стандартных растворов нитрата натрия путем последовательного десятикратного разведения рабочего раствора концентрацией 0,1моль/дм3 дистиллированной водой.
Погружают электродную пару в первый стандартный раствор (в ячейке - 20 см3) и при перемешивании измеряют потенциал индикаторного электрода относительно вспомогательного электрода. Запись величины потенциала производят после того, как значение перестает изменяться в пределах ±1 мВ. Затем повторяют эту процедуру для остальных значений рNO3.
По окончании калибровки промывают погружаемую часть электрода дистиллированной водой до рNO3=6.
Измеряя потенциал каждого стандартного раствора, вводят величины рNO3 и величины Е (мВ) в память прибора, следуя его инструкции по эксплуатации.
-
Определение нитрат-ионов по методу градуировочного графика
1. Построение градуировочного графика.
Поочередно измеряют потенциал для каждого раствора, начиная с самого разбавленного и переходя к более концентрированному. Перед каждым измерением электроды тщательно промывают дистиллированной водой до рNO3=6. На основе полученных данных строят гадуировочный график зависимости Е=f(рNO3).
2. Контрольная задача
Помещают в потенциометрическую ячейку 20 см3 контрольного раствора, повторяют измерения 5 раз. Находят искомую концентрацию по градуировочному графику.
-
Определение нитрат-ионов методом добавок
Для определения массовой доли по методу добавок в 6 мерных колб с контрольным образцом вместимостью 50 см3 вносят рассчитанные объемы 0,1 моль/дм3 раствора нитрата натрия. Объем всех растворов доводят до метки 1%-ным раствором алюмокалиевых квасцов. В потенциометрическую ячейку переносят 20 см3 раствора из каждой колбы, измеряют потенциал. Концентрацию нитратов определяют графически по графику зависимости потенциала Е от (рNO3)доб. (графический метод) и алгебраическим с использованием уравнения Нернста:
EM
= const
+ S*
рNO3
= const
– 58 lg
(CNO3-)
= const
– 58 lg
(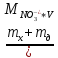 ,
где
,
где
S –крутизна электродной функции;
CNO3- - концентрация нитрат-ионов в растворе, моль/дм3;
mx – масса нитрат-ионов , г;
mд – масса добавки нитрата, г;
V – объем колбы;
MNO3- - молярная масса нитрат-иона, г/моль.
Содержание нитратов находили по формуле:
ω NO3-
, % =
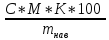 ,
где
,
где
C – концентрация нитрат-ионов, моль/дм3;
K – коэффициент разбавления;
M – молярная масса нитрат-иона, г/моль;
m –масса навески, г.
-
Определение хлороводородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования
Дифференцированное титрование смеси хлороводородной и уксусной кислоты в водном растворе невозможно провести с достаточной точностью из - за отсутствия заметного скачка потенциала в первой точке эквивалентности, отвечающей содержанию хлороводородной кислоты. Поэтому титрование осуществляют в двух аликвотных порциях анализируемого раствора: в первой - в водной среде определяют суммарное содержание кислот, во второй - в водно-ацетоновой среде титруют хлороводородную кислоту. Последнее становится возможным вследствие уменьшения степени диссоциации уксусной кислоты в присутствии ацетона.
-
Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
1. Бюретку заполняют раствором
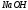 .
.
2. Аликвотную часть 5,0 см3 раствора HCl переносят в потенциометрическую ячейку с помощью пипетки. В раствор помещают стеклянный и хлоридсеребрянный электроды.
3. Включают магнитную мешалку, измеряют значение pH исходного раствора и записывают в таблицу 12.1.
4. Приливают по 0,5 см3 титранта до объема титранта 10,0 см3. Измерение pH проводят через 20 сек после прибавления очередной порции титранта и записывают в таблицу 12.1.(ориентировочное титрование).
5. Ориентировочно устанавливают точку эквивалентности по максимальному приращению pH.
6. Для точного определения точки эквивалентности титруют вторую порцию 5,0 см3 анализируемого раствора. Вблизи точки эквивалентности титрант приливают порциями по 0,2 см3. Значения pH записывают в таблицу 12.2.(точное титрование).
7. Точное титрование повторяют 2 раза .
8. По результатам точное титрования строят логарифмические и дифференциальные кривые титрования в координатах pH - f(V) и
ΔpH/ΔV = f(V).
9. Находят средний объем раствора, израсходованного на титрование.
10.
По известным формулам рассчитывают
молярную концентрацию эквивалентов
раствора
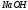 и
титра
и
титра
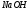 .
.
-
Контрольная задача. Определение содержания хлороводородной и уксусной кислот в анализируемом образце.
1. Анализируемый раствор переносят в мерную колбу вместимостью 100,0 см3 и доводят до метки дистиллированной водой.
2. В ячейку для титрования (химический стакан) отбирают аликвотную часть анализируемого раствора (10,0 см3).
3. Проводят ориентировочное и точное титрование раствором NaOH с точным титром (см. п.12.2.1.1.) до 15,0 см3 титранта, обнаруживая два скачка потенциала (первый - небольшой, второй - основной). Результаты записываю в таблицы 12.3 (ориентировочное титрование) и 12.4 (точное титрование).
4. По результатам точного титрования в водном растворе строят кривые титрования в координатах pH - f(V) и ΔpH/ΔV = f(V).
5. Для более точного определения содержания хлороводородной кислоты титрование проводят в водно-ацетоной смеси. Для этого отбирают аликвотную часть испытуемого раствора (10,0 см3) в ячейку для титрования, к ней приливают 10,0 см3 ацетона и проводят потенциометрическое титрование раствора NaOH с точным титром (см. пункт 12.2.1.1.). Результаты записываются в таблицу 12.5.(точное титрование).
6. По результатам титрования в водно-ацетоновом растворе строят кривые титрования в координатах pH - f(V) и ΔpH/ΔV = f(V) и находят средний объем раствора NaOH (V1) , пошедшего на титрование хлороводородной кислоты, по первому скачку и средний объем титранта, пошедшего на титрование уксусной кислоты (V2 - V1).
7. Рассчитывают содержание и концентрацию хлороводородной и уксусной кислот по известным формулам.
-
Определение фосфорной кислоты и дигидрофосфата натрия в растворе при их совместном присутствии методом потенциометрического титрования
Введение
Ход работы
-
Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
1. Бюретку заполняют раствором
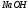 .
.
2. Аликвотную часть 5,0 см3 раствора HCl переносят в потенциометрическую ячейку с помощью пипетки. В раствор помещают стеклянный и хлоридсеребрянный электроды.
3. Включают магнитную мешалку, измеряют значение pH исходного раствора и записывают в таблицу 12.1.
4. Приливают по 0,5 см3 титранта до объема титранта 15,0 см3. Измерение pH проводят через 20 сек после прибавления очередной порции титранта и записывают в таблицу 12.1.(ориентировочное титрование).
5. Ориентировочно устанавливают точку эквивалентности по максимальному приращению pH.
6. Для точного определения точки эквивалентности титруют вторую порцию 5,0 см3 анализируемого раствора. Вблизи точки эквивалентности титрант приливают порциями по 0,2 см3. Значения pH записывают в таблицу 12.2.(точное титрование).
7. Точное титрование повторяют 2 раза .
8. По результатам точное титрования строят логарифмические и дифференциальные кривые титрования в координатах pH - f(V) и
ΔpH/ΔV = f(V).
9. Находят средний объем раствора, израсходованного на титрование.
10. По известным формулам
рассчитывают молярную концентрацию
эквивалентов раствора
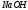 и
титра
и
титра
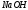 .
.
-
Контрольная задача. Определение содержания фосфорной кислоты и дигидрофосфата натрия в анализируемом образце.
1. Анализируемый раствор, включающий фосфорную кислоту (5,0 мл) и дигидрофосфат натрия (5,0 мл), переносят в кювету для титрования и разбавляют дистиллированной водой.


