ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.10.2024
Просмотров: 95
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
4 билетИсточник: https://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/367.html
Гибридизация электронных облаков
Термодинамическая система и ее состояния
Параметры термодинамической системы
Функци состояния термодинамической системы
12. Химическое равновесие. Обратимые и необратимые реакции.
Характеристика растворов. Процесс растворения.
Давление насыщенного пара над раствором. Закон рауля.
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
Лекция по теме «Химические источники тока»
Анод: Аl - 3 е = Аl3+
Катод: 2Н2О + О2 + 4 е = 4ОН.
Катодное же покрытие (например, свинцовое покрытие железа) в аналогичном случае перестает защищать основной металл и, создавая с ним гальванический элемент, усиливает своим присутствием его коррозию:
(А)Fе|Н2О/О2|Рb(К)
Анод: Fe - 2 e = Fe2+
Катод: Н2О + О2 + 4 е = 4ОН.
5. Электрохимическая защита:
а) катодная защита. Защищаемую конструкцию присоединяют к катоду внешнего источника тока, в результате она становится катодом, не окисляется, на ней идет восстановление компонентов среды. В качестве анода применяют любой металлический лом, ко-торый присоединяют к аноду внешнего источника тока. Таким способом защищают, например, подземные трубопроводы;
б) протекторная защита. Защищаемый металл соединяют с более активным металлом, имеющим меньший электродный потенциал. Последний служит анодом, растворяется и защищает основной металл. Так цинк является протектором для стального корпуса судна:
(А) Zn | Н2О/ О2| Fe (К)
Анод:Zn-2е =Zn2+
Катод: Н2О + О2 + 4e =4ОН.
Для более активной защиты металлических конструкций можно совмещать несколько способов защиты от коррозии, например, покрытие и катодную электрозащиту.
78 билет
-
Основные способы защиты металлов от коррозии
Для защиты металлов от коррозии применяются различные способы, которые условно можно разделить на следующие основные направления: легирование металлов; защитные покрытия (металлические, неметаллические); электрохимическая защита; изменение свойств коррозионной среды; рациональное конструирование изделий.
Легирование металлов. Это эффективный метод повышения коррозионной стойкости металлов. При легировании в состав сплава или металла вводят легирующие элементы (хром, никель, молибден и др.), вызывающие пассивность металла. Пассивацией называют процесс перехода металла или сплава в состояние его повышенной коррозионной устойчивости, вызванное торможением анодного процесса. Пассивное состояние металла объясняется образованием на его поверхности совершенной по структуре оксидной пленки (оксидная пленка обладает защитными свойствами при условии максимального сходства кристаллических решеток металла и образующегося оксида).
Широкое применение нашло легирование для защиты от газовой коррозии. Легированию подвергаются железо, алюминий, медь, магний, цинк, а также сплавы на их основе. В результате чего получаются сплавы с более высокой коррозионной стойкостью, чем сами металлы. Эти сплавы обладают одновременно жаростойкостью и жаропрочностью.
Жаростойкость – стойкость по отношению к газовой коррозии при высоких температурах. Жаропрочность – свойства конструкционного материала сохранять высокую механическую прочность при значительном повышении температуры. Жаростойкость обычно обеспечивается легированием металлов и сплавов, например, стали хромом, алюминием и кремнием. Эти элементы при высоких температурах окисляются энергичнее, чем железо, и образуют при этом плотные защитные пленки оксидов, например Al2O3 и Cr2O3 .
Легирование также используется с целью снижения скорости электрохимической коррозии, особенно коррозии с выделением водорода. К коррозионностойким сплавам, например, относятся нержавеющие стали, в которых легирующими компонентами служат хром, никель и другие металлы.
Защитные покрытия. Слои, искусственно создаваемые на поверхности металлических изделий для защиты их коррозии, называются защитными покрытиями. Нанесение защитных покрытий – самый распространенный метод борьбы с коррозией. Защитные покрытия не только предохраняют изделия от коррозии, но и придают поверхностям ряд ценных физико-химических свойств (износостойкость, электрическую проводимость и др.). Они подразделяются на металлические и неметаллические. Общими требованиями для всех видов защитных покрытий являются высокая адгезионная способность, сплошность и стойкость в агрессивной среде.
Металлические покрытия. Металлические покрытия занимают особое положение, так как их действие имеет двойственный характер. До тех пор, пока целостность слоя покрытия не нарушена, его защитное действие сводится к изоляции поверхности защищаемого металла от окружающей среды. Это не отличается от действия любого механического защитного слоя (окраска, оксидная пленка и т.д.). Металлические покрытия должны быть непроницаемы для коррозионных агентов.
При повреждении покрытия (или наличии пор) образуется гальванический элемент. Характер коррозионного разрушения основного металла определяется электрохимическими характеристиками обоих металлов. Защитные антикоррозионные покрытия могут быть катодными и анодными. К катодным покрытиям относятся покрытия, потенциалы которых в данной среде имеют более положительное значение, чем потенциал основного металла. Анодные покрытия имеют наиболее отрицательный потенциал, чем потенциал основного металла.
Так, например, по отношению к железу никелевое покрытие является катодным, а цинковое – анодным (рис. 2.).
При повреждении никелевого покрытия (рис. 2,а) на анодных участках происходит процесс окисления железа вследствие возникновения микрокоррозионных гальванических элементов. На катодных участках - восстановление водорода. Следовательно, катодные покрытия могут защищать металл от коррозии лишь при отсутствии пор и повреждения покрытия.
Местное повреждение защитного цинкового слоя ведет к дальнейшему его разрушению, при этом поверхность железа защищена от коррозии. На анодных участках происходит процесс окисления цинка. На катодных участках - восстановление водорода (рис. 2,б).
Электродные потенциалы металлов зависят от состава растворов
, поэтому при изменении состава раствора может меняться и характер покрытия.
Для получения металлических защитных покрытий применяются различные способы: электрохимический(гальванические покрытия);погружение в расплавленный металл(горячее цинкование, лужение);металлизация(нанесение расплавленного металла на защищаемую поверхность с помощью струи сжатого воздуха);химический(получение металлических покрытий с помощью восстановителей, например гидразина).
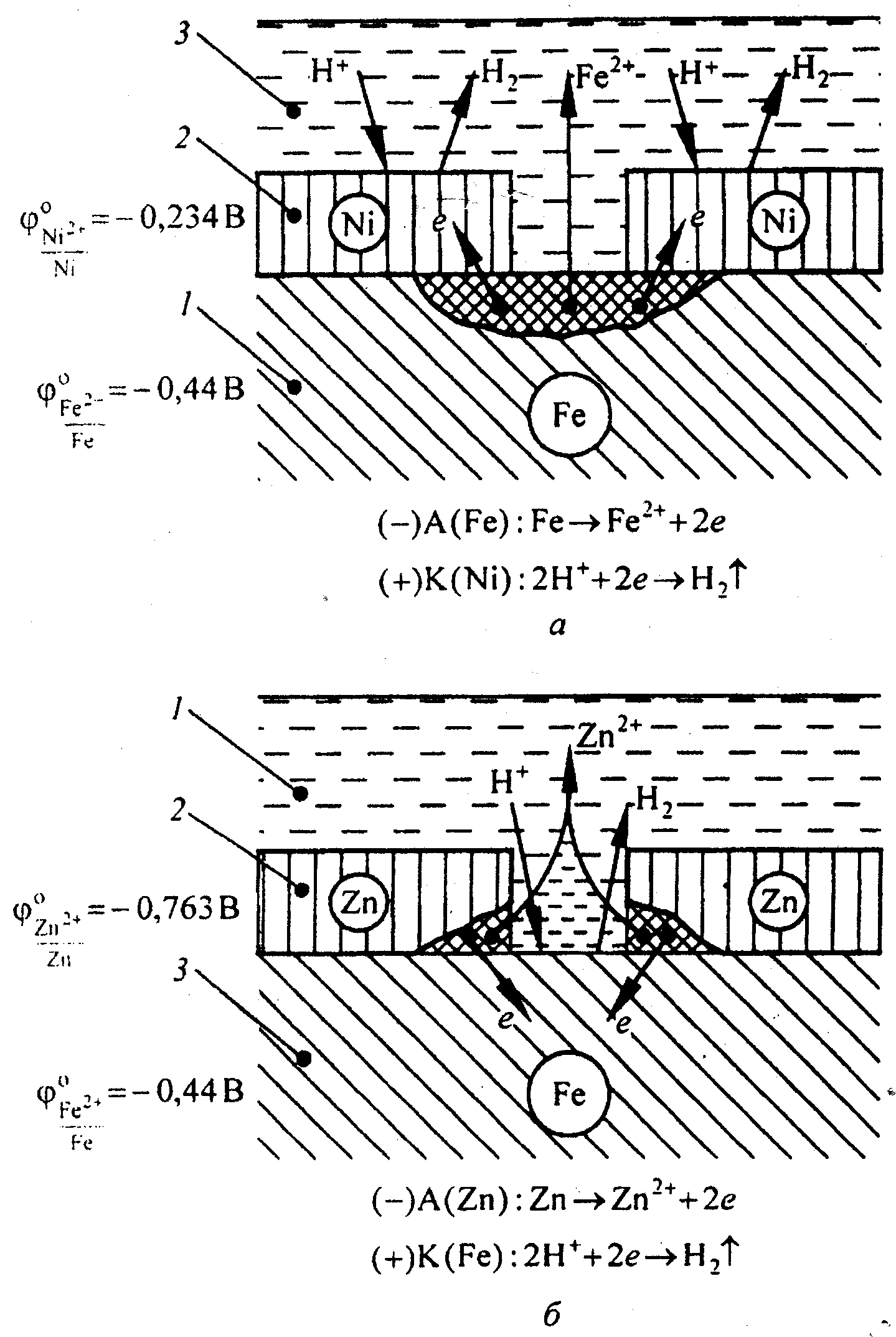
Рис. 2. Коррозия железа в кислотном растворе с катодным (а) и анодным (б) покрытиями: 1 – основной металл; 2 – покрытие; 3 – раствор электролита.
Материалами для металлических защитных покрытий могут быть как чистые металлы (цинк, кадмий, алюминий, никель, медь, хром, серебро и др.), так и их сплавы (бронза, латунь и др.).
Неметаллические защитные покрытия. Они могут быть как неорганическими, так и органическими. Защитное действие этих покрытий сводится в основном к изоляции металла от окружающей среды.
В качестве неорганических покрытий применяют неорганические эмали, оксиды металлов, соединение хрома, фосфора и др. К органическим относятся лакокрасочные покрытия, покрытия смолами, пластмассами, полимерными пленками, резиной.
Неорганические эмали по своему составу являются силикатами, т.е. соединениями кремния. К основным недостаткам таких покрытий относятся хрупкость и растрескивание при тепловых и механических ударах.
Лакокрасочные покрытия наиболее распространены. Лакокрасочное покрытие должно быть сплошным, газо -и водонепроницаемым, химически стойким, эластичным, обладать высоким сцеплением с материалом, механической прочностью и твердостью.
Химические способы очень разнообразны. К ним относится, например, обработка поверхности металла веществами, вступающими с ним в химическую реакцию и образующими на его поверхности пленку устойчивого химического соединения, в формировании которой принимает участие сам защищаемый металл. К числу таких способов относится оксидирование, фосфатирование, сульфи-дирование и др.
Оксидирование - процесс образования оксидных пленок на поверхности металлических изделий.
Современный метод оксидирования – химическая и электрохимическая обработка деталей в щелочных растворах.
Для железа и его сплавов наиболее часто используется щелочное оксидирование в растворе, содержащем NaOH, NaNO3, NaNO2 при температуре 135-140ОС. Оксидирование черных металлов называется воронением.
На анодных участках происходит процесс окисления:
Fe Fe2+ + 2
На катодных участках происходит процесс восстановления:
2 Н2О + О2 + 4 4ОН-
На поверхности металла в результате работы микрогальванических элементов образуется Fe(OH)2, который затем окисляется в Fe3O4. Оксидная пленка на малоуглеродистой стали имеет глубокий черный цвет, а на высокоуглеродистой стали – черный с сероватым оттенком.
Fe2+ + 2OH- Fe(OH)2;
12 Fe(OH)2 + NaNO3 4Fe3O4 + NaOH + 10 H2O + NH3
Противокоррозионные свойства поверхностной пленки оксидов невысоки, поэтому область применения этого метода ограничена. Основное назначение – декоративная отделка. Воронение используется в том случае, когда необходимо сохранить исходные размеры, так как оксидная пленка составляет всего 1,0 – 1,5 микрона.
Фосфатирование - метод получения фосфатных пленок на изделиях из цветных и черных металлов. Для фосфатирования металлическое изделие погружают в растворы фосфорной кислоты и ее кислых солей (H3PO4 + Mn(H2PO4)2) при температуре 96-98 оС.
На поверхности металла в результате работы микрогальванических элементов образуется фосфатная пленка, которая имеют сложный химический состав и содержит малорастворимые гидраты двух- и трех замещенных фосфатов марганца и железа: MnHPO4, Mn3(PO4)2 , FeHPO4 ,Fe3(PO4)2 nH2O.
На анодных участках происходит процесс окисления:
Fe Fe2+ + 2
На катодных участках происходит процесс восстановления водорода:
2Н++ 2 Н2 (рН < 7)
При взаимодействии ионов Fe2+ с анионами ортофосфорной кислоты и ее кислых солей образуются фосфатные пленки:
Fe2+ + H2PO-4 FeHPO4 + H+
3Fe2+ + 2 PO43- Fe3(PO4)2
Образующаяся фосфатная пленка химически связана с металлом и состоит из сросшихся между собой кристаллов, разделенных порами ультрамикроскопических размеров. Фосфатные пленки обладают хорошей адгезией, имеют развитую шероховатую поверхность. Они являются хорошим грунтом для нанесения лакокрасочных покрытий и пропитывающих смазок. Фосфатные покрытия применяются в основном для защиты металлов от коррозии в закрытых помещениях, а также как метод подготовки поверхности к последующей окраске или покрытию лаком. Недостатком фосфатных пленок является низкая прочность и эластичность, высокая хрупкость.

