ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.10.2024
Просмотров: 121
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
4 билетИсточник: https://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/367.html
Гибридизация электронных облаков
Термодинамическая система и ее состояния
Параметры термодинамической системы
Функци состояния термодинамической системы
12. Химическое равновесие. Обратимые и необратимые реакции.
Характеристика растворов. Процесс растворения.
Давление насыщенного пара над раствором. Закон рауля.
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
Лекция по теме «Химические источники тока»
) + 2
PbО2(тв) + 2 + 4 Н+(р-р)+ SO (р-р) PbSO4(тв) + 2 Н2О
«разрядка»
Pb(тв) + PbO2(тв) + 2 H2SO4 (р-р) 2 PbSO 4(тв) + 2H2O
«зарядка»
Cхема кислотного аккумулятора:
( - ) Pb / Pb2+ │H2SO4 │Pb2+ / PbO2 ( + )
Стандартные величины потенциалов для электродов свинцового аккумулятора имеют следующие значения: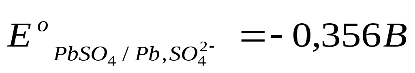 ,
,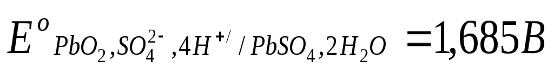 .
.
ЭДС аккумулятора, как химического источника тока, рассчитывается по уравнению:
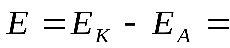
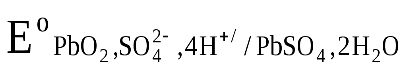 -
- 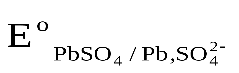 +
+ 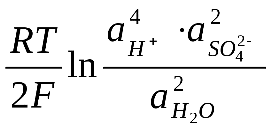
Из данного уравнения видно, что ЭДС аккумулятора зависит от концентрации (активности) серной кислоты, которая возрастает при заряде аккумулятора и уменьшается при его разояде. О степени разряда аккумулятора судят по концентрации электролита, т.е. концентрации H2SO4. Используя концентрированные растворы H2SO4, можно было бы увеличить ЭДС аккумулятора, однако при концентрации H2SO4 больше 39% резко уменьшается электропроводность растворов и увеличивается растворимость свинца, поэтому оптимальными являются 32 - 39 % - ные растворы H2SO4.
Во время заряда аккумулятора растет напряжение на его полюсах. В конце оно достигает такого значения, что начинается электролиз воды, сопровождающийся выделением водорода на катоде и кислорода – на аноде:
(-
 ) К : 2 Н2О + 2 Н2 +2 ОН-
) К : 2 Н2О + 2 Н2 +2 ОН-
(+) А : 4 ОН- О2 + 2 Н2О + 4
2 Н2О 2 Н2 + О2
Так называемое «кипение» электролита является признаком окончания заряда свинцового аккумулятора. Заряженный аккумулятор может быть сразу использован по назначению. При хранении же из него выливают электролит и промывают водой. В таком виде он может находиться до 2 лет и для его использования достаточно лишь залить электролит. При хранении незаряженного аккумулятора с раствором серной кислоты происходит его «сульфатирование» – образование на пластинках большого количества PSO
4. Когда кислотный аккумулятор работает, давая ток, PSO4 осаждается в очень мелкозернистой форме на поверхности электродов. Когда же аккумулятор выключен, мелкозернистый слой рекристаллизуется и образуются более крупные кристаллы, которые могут закупорить поры электрода, уменьшая его поверхность или отрываться от электрода и оседать на дно аккумулятора. Процесс сульфатации является основной причиной выхода аккумулятора из строя, поэтому нужно следить, чтобы аккумулятор не простаивал частично в разряженном состоянии.
Преимущества свинцового аккумулятора – высокий КПД (около 80 %), высокая ЭДС и относительно малое ее изменение при разряде, большая электрическая емкость, устойчивость в работе. Недостатки – большая масса и, следовательно, малая удельная емкость, саморазряд аккумулятора при хранении, малый срок службы (2 – 5 лет), а также токсичность свинца и сильные окислительные свойства H2SO4.
Щелочные аккумуляторыразличаются по материалу пластин отрицательно заряженного электрода. Наиболее распространенные из них кадмий - никелевые (Cd - Ni) и железо - никелевые ( Fe – Ni ) аккумуляторы. Активная масса положительных пластин состоит, в основном, из гидратированного оксида никеля (III), кроме того в ней содержится графит, добавляемый для увеличения электропроводности. Электролитом служит раствор КОН (20 %), содержащий небольшое количество LiOH. ЭДС заряженного аккумулятора (Cd - Ni) приблизительно равна 1,3 В.
Химическая и электрохимическая коррозия. Способы защиты металлов от коррозии
Коррозией называется процесс самопроизвольного разрушения металлов под воздействием внешней среды. Все случаи коррозии принято делать на два вида: химическую и электрохимическую.
Химическая коррозия - это окисление металлов, не сопровождающееся возникновением электрического тока. Примером химической коррозии является образование окалины на железе при высокой температуре без участия электролитов,
Электрохимическая коррозия - разрушение металла, обусловленное его окислением в среде электролита и сопровождающееся возникновением электрического тока в результате образования гальванического элемента, который в этом случае называют коррозионным гальваническим элементом. Работа коррозионного гальванического элемента обусловлена разностью потенциалов активного (анодного) участка и пассивного (катодного) участка. На анодных участках коррозионного гальванического элемента происходит окисление (растворение) основного металла
Анод: Me - Ze = Mez+ .
На катодных участках, в зависимости от состава-среды, может протекать восстановление кислорода, воды или ионов водорода, которые всегда содержатся в воде и растворах, соприкасающихся с воздухом.
Коррозия с участием кислорода называется коррозией с кислородной деполяризацией. Она описывается уравнениями:
Анодный процесс: Me - Ze = Mez+
Катодный процесс:
а) в кислой среде (рН < 7)
О2 + 4Н+ + 4ё=2Н2O;
б) в нейтральной и щелочной среде (рН > 7)
О2 + 2Н2О + 4e = 4OH.
Коррозия, сопровождающаяся выделением водорода на катоде, называется коррозией с водородной деполяризацией и описывается уравнениями:
Анодный процесс: Me - Z e = Mez+
Катодный процесс:
а) в кислой среде (рН < 7)
2Н+ + 2e = Н2↑;
б) в нейтральной и щелочной среде (рН ≥ 7)
2H2O + 2e = H2↑ + 2OH..
Таким образом, электрохимическая коррозия возможна при условии, когда электроны с анодных участков постоянно отводятся на катодные, а затем удаляются с них окислителем. Коррозионный гальванический элемент изображают следующим образом:
(A) MI| Н2О/Окислитель(О2 или Н+)| МII (примеси) (К).
Выделяемая иногда в отдельный вид грунтовая (почвенная) коррозия может быть сведена к одному из вышеперечисленных случаев.
Примеры решения задач
Пример 1. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если эта пара металлов находится в кислой среде (НСl). Составьте схему образующегося при этом гальванического элемента. Какой процесс будет протекать на катоде?
Решение. Исходя из положения металлов в ряду напряжений, находим, что хром более активный металл: (φ0Cr2+/Cr = -0,74 В,φ0Cu2+/Cu = +0,34 В). В образующемся гальваническом элементе он будет выполнять роль анода, а медь - катода:
(А)Сr|Н2О/НС1|Сu(К).
Хромовый анод растворяется, а на медном катоде выделяется водород:
Анод:Сr-3е =Сr3+
Катод: 2Н2+ 2е =Н2↑
Пример 2. Какие процессы протекают при коррозии технического железа в атмосферных условиях?
Решение. Техническое железо содержит примеси углерода и некоторых металлов, которые, как правило, менее активны, чем железо, и выполняют роль катода в образующемся гальваническом элементе, основная масса железа является анодом. Адсорбированная на поверхности железа вода, с растворенными в ней кислородом и другими газами, образует пленку электролита.
Схема, образующегося гальванического элемента имеет вид
(A)Fe|H2O/O2|Me(K).
При работе гальванического элемента протекают процессы:
Анод:Fе-2е =Fe2+
Катод: 2Н2О + О2 + 4 e - 4ОH.
Вторичные процессы: Fe2+ +2ОH. = Fe(OH)2,
4Fe(OH)2 + О2 + Н2О = 4Fe(OH)3.
На скорость коррозии влияют как внутренние факторы (наличие дефектов кристаллической решетки металла, механические напряжения и др.), так и внешние: температура, природа и состав электролита. С повышением температуры скорость коррозии, как и большинства химических реакций, возрастает. Усиливают коррозию содержащаяся в атмосфере промышленных городов пыль, SO2, СO2 и другие газы. Поэтому в городах коррозия протекает в 5-10 раз быстрее, чем в сельской местности. Ионы Сl-, присутствующие в морской воде, являются катализаторами коррозии железа и его сплавов, так как адсорбируясь на поверхности металла, разрушают или препятствуют образованию на нем защитных слоев. Кроме того, скорость коррозии двух контактирующих металлов будет тем больше, чем больше разность потенциалов этих металлов. Полностью предотвратить процессы коррозии металлов практически не удается, однако существуют
способы защиты металлов от коррозии.
1. Изменение коррозионной среды - этот метод пригоден для тех случаев, когда защищаемые изделия эксплуатируются в небольшом объеме. Суть метода состоит в удалении из электролита растворенного кислорода или добавлении к этому раствору веществ, замедляющих коррозию - ингибиторов.
2. Легирование металлов. Это введение в состав сплавов компонентов, повышающих химическую стойкость. Наибольшее применение находят нержавеющие стали, в состав которых входит хром (до 15 %) и никель (до 10 %). Кроме того, в качестве легирующих компонентов используют марганец, кремний, вольфрам, молибден, титан и другие металлы.
3. Неметаллические покрытия. Механически защищают металлы от коррозии, изолируя их от влияния внешней среды. Неметаллические покрытия делятся на неорганические и органические. Из неорганических покрытий наиболее распространены оксидные и фосфатные пленки. Так, при кипячении железа в растворе солей фосфорной кислоты (обычно солей Fe и Мn) получают фосфатные пленки, хорошо защищающие от коррозии в атмосфере. Среди органических, покрытий наиболее распространенными являются масляные краски, лаки, полимерные пленки. Лакокрасочные покрытия - самый дешевый метод защиты от коррозии.
4. Металлические покрытия. По характеру защитного действия различают анодные и катодные покрытия. Анодным является покрытие металлом, электродный потенциал которого меньше, чем у защищаемого металла. Покрытие из металла менее активного (с большим электродным потенциалом), чем защищаемый металл, называется катодным. Если покрытие не нарушено и полностью изолирует основной металл от воздействия окружающей среды, принципиального различия между анодными и катодными покрытиями нет. При нарушении слоя защищающего металла возникают коррозионные гальванические элементы, в которых защищаемый металл может играть роль или инертного катода, или активного анода. Так, при нарушении в атмосферных условиях алюминиевого покрытия на медном изделии (φ0Al3+/Al= -1,67 В, φ0 Cu2+/Cu = +0,34 В) возникает гальванический элемент (А)А1|Н2О/О2|Cu(К).
В этом элементе, покрывающий металл Аl является анодом, он разрушается (окисляется) и, растворяясь, защищает основной металл, несмотря на нарушение целостности покрывающего слоя:
PbО2(тв) + 2 + 4 Н+(р-р)+ SO (р-р) PbSO4(тв) + 2 Н2О
«разрядка»
Pb(тв) + PbO2(тв) + 2 H2SO4 (р-р) 2 PbSO 4(тв) + 2H2O
«зарядка»
Cхема кислотного аккумулятора:
( - ) Pb / Pb2+ │H2SO4 │Pb2+ / PbO2 ( + )
Стандартные величины потенциалов для электродов свинцового аккумулятора имеют следующие значения:
ЭДС аккумулятора, как химического источника тока, рассчитывается по уравнению:
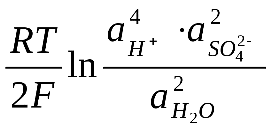
Из данного уравнения видно, что ЭДС аккумулятора зависит от концентрации (активности) серной кислоты, которая возрастает при заряде аккумулятора и уменьшается при его разояде. О степени разряда аккумулятора судят по концентрации электролита, т.е. концентрации H2SO4. Используя концентрированные растворы H2SO4, можно было бы увеличить ЭДС аккумулятора, однако при концентрации H2SO4 больше 39% резко уменьшается электропроводность растворов и увеличивается растворимость свинца, поэтому оптимальными являются 32 - 39 % - ные растворы H2SO4.
Во время заряда аккумулятора растет напряжение на его полюсах. В конце оно достигает такого значения, что начинается электролиз воды, сопровождающийся выделением водорода на катоде и кислорода – на аноде:
(-

 ) К : 2 Н2О + 2 Н2 +2 ОН-
) К : 2 Н2О + 2 Н2 +2 ОН-(+) А : 4 ОН- О2 + 2 Н2О + 4
2 Н2О 2 Н2 + О2
Так называемое «кипение» электролита является признаком окончания заряда свинцового аккумулятора. Заряженный аккумулятор может быть сразу использован по назначению. При хранении же из него выливают электролит и промывают водой. В таком виде он может находиться до 2 лет и для его использования достаточно лишь залить электролит. При хранении незаряженного аккумулятора с раствором серной кислоты происходит его «сульфатирование» – образование на пластинках большого количества PSO
4. Когда кислотный аккумулятор работает, давая ток, PSO4 осаждается в очень мелкозернистой форме на поверхности электродов. Когда же аккумулятор выключен, мелкозернистый слой рекристаллизуется и образуются более крупные кристаллы, которые могут закупорить поры электрода, уменьшая его поверхность или отрываться от электрода и оседать на дно аккумулятора. Процесс сульфатации является основной причиной выхода аккумулятора из строя, поэтому нужно следить, чтобы аккумулятор не простаивал частично в разряженном состоянии.
Преимущества свинцового аккумулятора – высокий КПД (около 80 %), высокая ЭДС и относительно малое ее изменение при разряде, большая электрическая емкость, устойчивость в работе. Недостатки – большая масса и, следовательно, малая удельная емкость, саморазряд аккумулятора при хранении, малый срок службы (2 – 5 лет), а также токсичность свинца и сильные окислительные свойства H2SO4.
Щелочные аккумуляторыразличаются по материалу пластин отрицательно заряженного электрода. Наиболее распространенные из них кадмий - никелевые (Cd - Ni) и железо - никелевые ( Fe – Ni ) аккумуляторы. Активная масса положительных пластин состоит, в основном, из гидратированного оксида никеля (III), кроме того в ней содержится графит, добавляемый для увеличения электропроводности. Электролитом служит раствор КОН (20 %), содержащий небольшое количество LiOH. ЭДС заряженного аккумулятора (Cd - Ni) приблизительно равна 1,3 В.
77 билет
Коррозия металлов и методы защиты от коррозии
Химическая и электрохимическая коррозия. Способы защиты металлов от коррозии
Коррозией называется процесс самопроизвольного разрушения металлов под воздействием внешней среды. Все случаи коррозии принято делать на два вида: химическую и электрохимическую.
Химическая коррозия - это окисление металлов, не сопровождающееся возникновением электрического тока. Примером химической коррозии является образование окалины на железе при высокой температуре без участия электролитов,
Электрохимическая коррозия - разрушение металла, обусловленное его окислением в среде электролита и сопровождающееся возникновением электрического тока в результате образования гальванического элемента, который в этом случае называют коррозионным гальваническим элементом. Работа коррозионного гальванического элемента обусловлена разностью потенциалов активного (анодного) участка и пассивного (катодного) участка. На анодных участках коррозионного гальванического элемента происходит окисление (растворение) основного металла
Анод: Me - Ze = Mez+ .
На катодных участках, в зависимости от состава-среды, может протекать восстановление кислорода, воды или ионов водорода, которые всегда содержатся в воде и растворах, соприкасающихся с воздухом.
Коррозия с участием кислорода называется коррозией с кислородной деполяризацией. Она описывается уравнениями:
Анодный процесс: Me - Ze = Mez+
Катодный процесс:
а) в кислой среде (рН < 7)
О2 + 4Н+ + 4ё=2Н2O;
б) в нейтральной и щелочной среде (рН > 7)
О2 + 2Н2О + 4e = 4OH.
Коррозия, сопровождающаяся выделением водорода на катоде, называется коррозией с водородной деполяризацией и описывается уравнениями:
Анодный процесс: Me - Z e = Mez+
Катодный процесс:
а) в кислой среде (рН < 7)
2Н+ + 2e = Н2↑;
б) в нейтральной и щелочной среде (рН ≥ 7)
2H2O + 2e = H2↑ + 2OH..
Таким образом, электрохимическая коррозия возможна при условии, когда электроны с анодных участков постоянно отводятся на катодные, а затем удаляются с них окислителем. Коррозионный гальванический элемент изображают следующим образом:
(A) MI| Н2О/Окислитель(О2 или Н+)| МII (примеси) (К).
Выделяемая иногда в отдельный вид грунтовая (почвенная) коррозия может быть сведена к одному из вышеперечисленных случаев.
Примеры решения задач
Пример 1. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если эта пара металлов находится в кислой среде (НСl). Составьте схему образующегося при этом гальванического элемента. Какой процесс будет протекать на катоде?
Решение. Исходя из положения металлов в ряду напряжений, находим, что хром более активный металл: (φ0Cr2+/Cr = -0,74 В,φ0Cu2+/Cu = +0,34 В). В образующемся гальваническом элементе он будет выполнять роль анода, а медь - катода:
(А)Сr|Н2О/НС1|Сu(К).
Хромовый анод растворяется, а на медном катоде выделяется водород:
Анод:Сr-3е =Сr3+
Катод: 2Н2+ 2е =Н2↑
Пример 2. Какие процессы протекают при коррозии технического железа в атмосферных условиях?
Решение. Техническое железо содержит примеси углерода и некоторых металлов, которые, как правило, менее активны, чем железо, и выполняют роль катода в образующемся гальваническом элементе, основная масса железа является анодом. Адсорбированная на поверхности железа вода, с растворенными в ней кислородом и другими газами, образует пленку электролита.
Схема, образующегося гальванического элемента имеет вид
(A)Fe|H2O/O2|Me(K).
При работе гальванического элемента протекают процессы:
Анод:Fе-2е =Fe2+
Катод: 2Н2О + О2 + 4 e - 4ОH.
Вторичные процессы: Fe2+ +2ОH. = Fe(OH)2,
4Fe(OH)2 + О2 + Н2О = 4Fe(OH)3.
На скорость коррозии влияют как внутренние факторы (наличие дефектов кристаллической решетки металла, механические напряжения и др.), так и внешние: температура, природа и состав электролита. С повышением температуры скорость коррозии, как и большинства химических реакций, возрастает. Усиливают коррозию содержащаяся в атмосфере промышленных городов пыль, SO2, СO2 и другие газы. Поэтому в городах коррозия протекает в 5-10 раз быстрее, чем в сельской местности. Ионы Сl-, присутствующие в морской воде, являются катализаторами коррозии железа и его сплавов, так как адсорбируясь на поверхности металла, разрушают или препятствуют образованию на нем защитных слоев. Кроме того, скорость коррозии двух контактирующих металлов будет тем больше, чем больше разность потенциалов этих металлов. Полностью предотвратить процессы коррозии металлов практически не удается, однако существуют
способы защиты металлов от коррозии.
1. Изменение коррозионной среды - этот метод пригоден для тех случаев, когда защищаемые изделия эксплуатируются в небольшом объеме. Суть метода состоит в удалении из электролита растворенного кислорода или добавлении к этому раствору веществ, замедляющих коррозию - ингибиторов.
2. Легирование металлов. Это введение в состав сплавов компонентов, повышающих химическую стойкость. Наибольшее применение находят нержавеющие стали, в состав которых входит хром (до 15 %) и никель (до 10 %). Кроме того, в качестве легирующих компонентов используют марганец, кремний, вольфрам, молибден, титан и другие металлы.
3. Неметаллические покрытия. Механически защищают металлы от коррозии, изолируя их от влияния внешней среды. Неметаллические покрытия делятся на неорганические и органические. Из неорганических покрытий наиболее распространены оксидные и фосфатные пленки. Так, при кипячении железа в растворе солей фосфорной кислоты (обычно солей Fe и Мn) получают фосфатные пленки, хорошо защищающие от коррозии в атмосфере. Среди органических, покрытий наиболее распространенными являются масляные краски, лаки, полимерные пленки. Лакокрасочные покрытия - самый дешевый метод защиты от коррозии.
4. Металлические покрытия. По характеру защитного действия различают анодные и катодные покрытия. Анодным является покрытие металлом, электродный потенциал которого меньше, чем у защищаемого металла. Покрытие из металла менее активного (с большим электродным потенциалом), чем защищаемый металл, называется катодным. Если покрытие не нарушено и полностью изолирует основной металл от воздействия окружающей среды, принципиального различия между анодными и катодными покрытиями нет. При нарушении слоя защищающего металла возникают коррозионные гальванические элементы, в которых защищаемый металл может играть роль или инертного катода, или активного анода. Так, при нарушении в атмосферных условиях алюминиевого покрытия на медном изделии (φ0Al3+/Al= -1,67 В, φ0 Cu2+/Cu = +0,34 В) возникает гальванический элемент (А)А1|Н2О/О2|Cu(К).
В этом элементе, покрывающий металл Аl является анодом, он разрушается (окисляется) и, растворяясь, защищает основной металл, несмотря на нарушение целостности покрывающего слоя:

