ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.10.2024
Просмотров: 117
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
4 билетИсточник: https://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/367.html
Гибридизация электронных облаков
Термодинамическая система и ее состояния
Параметры термодинамической системы
Функци состояния термодинамической системы
12. Химическое равновесие. Обратимые и необратимые реакции.
Характеристика растворов. Процесс растворения.
Давление насыщенного пара над раствором. Закон рауля.
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
Лекция по теме «Химические источники тока»
. Например, реакция окисления SO2до SO3:
2SO2 (г)+О2 (r) = 2SO3 (г), ΔH = —396,1 кДж/моль
Реакция образования SO3 сопровождается выделением теплоты, т. е. является экзотермическим процессом. Обратный процесс, т. е. разложение SO3 до исходных веществ, является эндотермическим. Если при установившемся равновесии повышать температуру, то это воздействие сместит равновесие в ту сторону, которая идет с поглощением теплоты. Таковым является разложение SO3.
Так как при равновесии соблюдается условие ΔН = TΔS, то изменение температуры приводит к изменению и ΔН. При повышении температуры в системе усиливается действие энтропийного фактора (TΔS > 0), т. е. усиливается эндотермический процесс. При понижении температуры действие энтропийного фактора ослабевает и начинает преобладать экзотермический процесс.
Влияние давления определяется изменением объема, которое происходит в ходе реакции. В данном примере по мере образования SO3 давление системы будет понижаться, поскольку из каждых двух молекул SO2 и одной молекулы О2, образуются только две молекулы SO3. Следовательно, при изменении давления равновесие будет смещаться в ту сторону, которая противодействует данному изменению; при увеличении давления равновесие смещается в сторону образования меньшего числа молекул газа, а уменьшение давления смещает равновесие в сторону образования большего числа молекул. Из этого следует, что в рассматриваемой равновесной системе увеличение давления сместит реакцию в сторону образования SO3. При изменении концентрации компонентов равновесной системы значение константы равновесия остается неизменным, однако само равновесие смещается, так как при этом создаются более благоприятные условия для протекания прямой пли обратной реакции. Увеличение концентрации SO2 или О2 (или одновременно и того и другого) сместит реакцию в сторону образования SO3, как процесса, приводящего к уменьшению концентрации SO2 и О2. Если по мере образования из реакционной среды удалять SO3, то равновесие тоже сдвинется вправо.
Таким образом, если в реакционную смесь ввести избыток одного из исходных веществ, то равновесие смещается в сторону образования продуктов реакции. Аналогичный результат может быть достигнут путем удаления из системы продуктов реакции.
K = [SO3]²/([SO2]²*[O2])
Vобр = k*[SO3]²
При увеличении концентрации SO3 в 4 раза скорость обратной реакции увеличится в 16 раз.
Реакция идет по уравнению: 2NО + О2 = 2NO2. Напишите выражение для константы химического равновесия. Как следует изменить концентрацию веществ и давление, чтобы повысить выход NO? Расчёты обоснуйте теоретическими положениями.
Константа равновесия: K = [CОCl2] / ([CO]*[Cl2]);
В результате реакции образовалось 0,45 моль COCl2.
Было затрачено 0,45 моль CO и 0,45 моль Cl2.
Равновесные концентрации:
[CОCl2] = 0,45 моль/л;
[CO] = [Cl2] = 2 - 0,45 = 1,55 моль/л;
К = 0,45/1,55*1,55 = 0,187.

P2 = P1/3
------------
v2/v1 - ?
Оба реагента - газообразные.
Начальная скорость реакции
v1 = k*[N2]*[H2]^3
После уменьшения давления концентрации также уменьшатся в 3 раза
Скорость реакции
v2 = k*[N2/3]*[H2/3]^3 = k*[N2]*[H2]^3 /81 = v1/81
v2/v1 = 1/81
Скорость уменьшится в 81 раз
а) 2SО2 + О2 ↔2SО3 ΔН0298 = -196,6кДж
обозначим [SО2] =а , [О2]=в, [SО3]=с, тогда V1прям=k*а2b; V1обр= k*с2 Допустим, увеличим давление в первой системе в два раза. Тогда
V2прям =k*(2а )2*2b =k*8а2b
Скорость прямой реакции увеличилась в 8 раз:
V2прям/ V1прям= k*4а2b/ k*а2b=4
Изменение скорости обратной реакции:
V2обр=k*(2с)2=4с2
V2обр /V1обр=4с2/с2=4
Т.е. смещение при увеличении давления в сторону образования продуктов реакции. Реакция экзотермическая, при увеличении температуры сместится влево.
Константа равновесия для данной реакции:
К = [SО3]2/[ SО2]2[ О2]
b) N2 + О2 ↔2NО ΔН0298 =+180,7кДж
Объем газовой смеси в ходе реакции не меняется, следовательно изменение давления на скорость реакции не влияет. Реакция эндотермическая
, следовательно при увеличении температуры равновесие сместится вправо. Константа равновесия для данной реакции:
К= [NО]2/[ N2][ О2]
По принципу Ле-Шателье, равновесие смещается в сторону, уменьшающую воздействие на систему ("система всегда действует назло, наоборот!"). Давление зависит от кол-ва молей газа на единицу объема, т.е. от общей концентрации газа в системе. При понижении давления равновесие смещается в сторону реакции, в которой давление в системе увеличивается за счет увеличения кол-ва газа. Поэтому на систему N2 + 02 ⇆ 2NО понижение давления не влияет и она остается в состоянии равновесия, т.к. в ней из 2 моль газа образуются 2 моль газа, т.е. общая конц-я газа не изменяется. Напротив, в системе N2 + ЗН2 ⇆ 2NНЗ будет смещение в сторону обратной реакции, в кот. из 2 моль газа образуются 4 моль газа, общая конц-я газа повышается и давление растет.
Кинетические уравнения для простых реакций системы N2 + ЗН2 ⇆ 2NНЗ :
для прямой реакции: v пр. =k∙[N2] ∙ [Н2]³
для обратной v обр. =k∙[NНЗ]²
При понижении давления в 2 раза конц-и в-в снижаются в 2 раза:
для прямой реакции:: v′пр. =k∙[½N2] ∙ [½Н2]³ = 1/16k∙[N2] ∙ [Н2]³ = 1/16 v пр.
для обратной v′обр.=k∙[½NНЗ]²= ¼k∙[NНЗ]² = ¼ v обр.
До понижения давления в состоянии равновесия v пр. = v обр.
В рез. понижения давления скорость прямой реакции снизилась в 16 раз, а обратной - только в 4 раза, т.е. v′обр. > v′пр., смещение в сторону обратной реакции.
Выражение для константы равновесия: Кeq = [NНЗ]²/([N2]∙[Н2]³)
Кинетические уравнения для простых реакций системы N2 + 02 ⇆ 2NО :
для прямой реакции: v пр. =k∙[N2] ∙ [О2]
для обратной v обр. =k∙[NО]²
При понижении давления в 2 раза конц-и в-в снижаются в 2 раза:
для прямой реакции:: v′пр. =k∙[½N2] ∙ [½О2] = ¼k∙[N2] ∙ [О2] = ¼ v пр.
для обратной v′обр.=k∙[½NО]²= ¼k∙[NО]² = ¼ v обр.
До понижения давления в состоянии равновесия v пр. = v обр.
В рез. понижения давления скорости обеих реакций снизились в 4 раза, т.е. по-прежнему соблюдается равенство v′обр. = v′пр., система осталась в состоянии равновесия.
Выражение для константы равновесия: Кeq =NО]²/([N2]∙[О2])

если исходные концентрации [СО] = 3 моль/л, [Н2O] = 2 моль/л.
V=k[H2O] чтобы скорость возросла в 100 раз надо давление увеличить в 100 раз при условии что вода в виде паров , если в жидком состоянии , то давление не влияет на скорость реакции.
Кр=[CO2]^2 / ( [CO]^2 * [O2]) = 0,1^2 / (0,2^2 *0,1) =...
Сисх= С равн + С реаг. в момент равновесия [CO2=0,1 моль/л, значит СО прореагировало 0,1 моль, а О2 0,05 моль ( см.стех. к-ты)
Сисх(СО)=0,2+0,1=0,3 моль/л
Сисх(О2)=0,1+0,05=0,15 моль/л
http://buzani.ru/zadachi/khimiya-glinka/1145-konstanta-ravnovesiya-reaktsii-zadachi-366-368
вместо 10 градусов 50 градусов
I Теоретическая часть
На поверхности раздела фаз наблюдается различные поверхностные явления.
Фаза – однородная часть гетерогенной системы, которая имеет одинаковый химический состав и одинаковые значения термодинамических параметров.
Границы раздела фаз бывают:
1. подвижные – газ– жидкость и жидкость – жидкость
2. неподвижные газ- – твердое тело, жидкость – твердое тело, твердое тело – твердое тело.
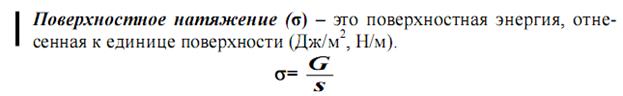
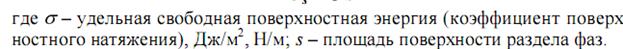
G – свободная поверхностная энергия.
Сорбция и ее виды
Сорбция (от латин. «sorbeo» - поглощаю, втягиваю)– гетерогенный процесс самопроизвольного поглощения твердым телом или жидкостью (сорбентом) веществ (сорбтива) из окружающей среды.
В зависимости от степени прочности связывания сорбтива сорбентом сорбция может быть обратимой и необратимой. Если она является обратимой (что бывает чаще), то в системе устанавливается равновесие
2SO2 (г)+О2 (r) = 2SO3 (г), ΔH = —396,1 кДж/моль
Реакция образования SO3 сопровождается выделением теплоты, т. е. является экзотермическим процессом. Обратный процесс, т. е. разложение SO3 до исходных веществ, является эндотермическим. Если при установившемся равновесии повышать температуру, то это воздействие сместит равновесие в ту сторону, которая идет с поглощением теплоты. Таковым является разложение SO3.
Так как при равновесии соблюдается условие ΔН = TΔS, то изменение температуры приводит к изменению и ΔН. При повышении температуры в системе усиливается действие энтропийного фактора (TΔS > 0), т. е. усиливается эндотермический процесс. При понижении температуры действие энтропийного фактора ослабевает и начинает преобладать экзотермический процесс.
Влияние давления определяется изменением объема, которое происходит в ходе реакции. В данном примере по мере образования SO3 давление системы будет понижаться, поскольку из каждых двух молекул SO2 и одной молекулы О2, образуются только две молекулы SO3. Следовательно, при изменении давления равновесие будет смещаться в ту сторону, которая противодействует данному изменению; при увеличении давления равновесие смещается в сторону образования меньшего числа молекул газа, а уменьшение давления смещает равновесие в сторону образования большего числа молекул. Из этого следует, что в рассматриваемой равновесной системе увеличение давления сместит реакцию в сторону образования SO3. При изменении концентрации компонентов равновесной системы значение константы равновесия остается неизменным, однако само равновесие смещается, так как при этом создаются более благоприятные условия для протекания прямой пли обратной реакции. Увеличение концентрации SO2 или О2 (или одновременно и того и другого) сместит реакцию в сторону образования SO3, как процесса, приводящего к уменьшению концентрации SO2 и О2. Если по мере образования из реакционной среды удалять SO3, то равновесие тоже сдвинется вправо.
Таким образом, если в реакционную смесь ввести избыток одного из исходных веществ, то равновесие смещается в сторону образования продуктов реакции. Аналогичный результат может быть достигнут путем удаления из системы продуктов реакции.
31 билет
K = [SO3]²/([SO2]²*[O2])
Vобр = k*[SO3]²
При увеличении концентрации SO3 в 4 раза скорость обратной реакции увеличится в 16 раз.
32 билет
Реакция идет по уравнению: 2NО + О2 = 2NO2. Напишите выражение для константы химического равновесия. Как следует изменить концентрацию веществ и давление, чтобы повысить выход NO? Расчёты обоснуйте теоретическими положениями.
33 билет
Константа равновесия: K = [CОCl2] / ([CO]*[Cl2]);
В результате реакции образовалось 0,45 моль COCl2.
Было затрачено 0,45 моль CO и 0,45 моль Cl2.
Равновесные концентрации:
[CОCl2] = 0,45 моль/л;
[CO] = [Cl2] = 2 - 0,45 = 1,55 моль/л;
К = 0,45/1,55*1,55 = 0,187.
34 билет

35 билет
P2 = P1/3
------------
v2/v1 - ?
Оба реагента - газообразные.
Начальная скорость реакции
v1 = k*[N2]*[H2]^3
После уменьшения давления концентрации также уменьшатся в 3 раза
Скорость реакции
v2 = k*[N2/3]*[H2/3]^3 = k*[N2]*[H2]^3 /81 = v1/81
v2/v1 = 1/81
Скорость уменьшится в 81 раз
36 билет
а) 2SО2 + О2 ↔2SО3 ΔН0298 = -196,6кДж
обозначим [SО2] =а , [О2]=в, [SО3]=с, тогда V1прям=k*а2b; V1обр= k*с2 Допустим, увеличим давление в первой системе в два раза. Тогда
V2прям =k*(2а )2*2b =k*8а2b
Скорость прямой реакции увеличилась в 8 раз:
V2прям/ V1прям= k*4а2b/ k*а2b=4
Изменение скорости обратной реакции:
V2обр=k*(2с)2=4с2
V2обр /V1обр=4с2/с2=4
Т.е. смещение при увеличении давления в сторону образования продуктов реакции. Реакция экзотермическая, при увеличении температуры сместится влево.
Константа равновесия для данной реакции:
К = [SО3]2/[ SО2]2[ О2]
b) N2 + О2 ↔2NО ΔН0298 =+180,7кДж
Объем газовой смеси в ходе реакции не меняется, следовательно изменение давления на скорость реакции не влияет. Реакция эндотермическая
, следовательно при увеличении температуры равновесие сместится вправо. Константа равновесия для данной реакции:
К= [NО]2/[ N2][ О2]
37 билет
По принципу Ле-Шателье, равновесие смещается в сторону, уменьшающую воздействие на систему ("система всегда действует назло, наоборот!"). Давление зависит от кол-ва молей газа на единицу объема, т.е. от общей концентрации газа в системе. При понижении давления равновесие смещается в сторону реакции, в которой давление в системе увеличивается за счет увеличения кол-ва газа. Поэтому на систему N2 + 02 ⇆ 2NО понижение давления не влияет и она остается в состоянии равновесия, т.к. в ней из 2 моль газа образуются 2 моль газа, т.е. общая конц-я газа не изменяется. Напротив, в системе N2 + ЗН2 ⇆ 2NНЗ будет смещение в сторону обратной реакции, в кот. из 2 моль газа образуются 4 моль газа, общая конц-я газа повышается и давление растет.
Кинетические уравнения для простых реакций системы N2 + ЗН2 ⇆ 2NНЗ :
для прямой реакции: v пр. =k∙[N2] ∙ [Н2]³
для обратной v обр. =k∙[NНЗ]²
При понижении давления в 2 раза конц-и в-в снижаются в 2 раза:
для прямой реакции:: v′пр. =k∙[½N2] ∙ [½Н2]³ = 1/16k∙[N2] ∙ [Н2]³ = 1/16 v пр.
для обратной v′обр.=k∙[½NНЗ]²= ¼k∙[NНЗ]² = ¼ v обр.
До понижения давления в состоянии равновесия v пр. = v обр.
В рез. понижения давления скорость прямой реакции снизилась в 16 раз, а обратной - только в 4 раза, т.е. v′обр. > v′пр., смещение в сторону обратной реакции.
Выражение для константы равновесия: Кeq = [NНЗ]²/([N2]∙[Н2]³)
Кинетические уравнения для простых реакций системы N2 + 02 ⇆ 2NО :
для прямой реакции: v пр. =k∙[N2] ∙ [О2]
для обратной v обр. =k∙[NО]²
При понижении давления в 2 раза конц-и в-в снижаются в 2 раза:
для прямой реакции:: v′пр. =k∙[½N2] ∙ [½О2] = ¼k∙[N2] ∙ [О2] = ¼ v пр.
для обратной v′обр.=k∙[½NО]²= ¼k∙[NО]² = ¼ v обр.
До понижения давления в состоянии равновесия v пр. = v обр.
В рез. понижения давления скорости обеих реакций снизились в 4 раза, т.е. по-прежнему соблюдается равенство v′обр. = v′пр., система осталась в состоянии равновесия.
Выражение для константы равновесия: Кeq =NО]²/([N2]∙[О2])
38 билет

если исходные концентрации [СО] = 3 моль/л, [Н2O] = 2 моль/л.
39 билет
V=k[H2O] чтобы скорость возросла в 100 раз надо давление увеличить в 100 раз при условии что вода в виде паров , если в жидком состоянии , то давление не влияет на скорость реакции.
40 билет
Кр=[CO2]^2 / ( [CO]^2 * [O2]) = 0,1^2 / (0,2^2 *0,1) =...
Сисх= С равн + С реаг. в момент равновесия [CO2=0,1 моль/л, значит СО прореагировало 0,1 моль, а О2 0,05 моль ( см.стех. к-ты)
Сисх(СО)=0,2+0,1=0,3 моль/л
Сисх(О2)=0,1+0,05=0,15 моль/л
41 билет
http://buzani.ru/zadachi/khimiya-glinka/1145-konstanta-ravnovesiya-reaktsii-zadachi-366-368
вместо 10 градусов 50 градусов
42 билет
I Теоретическая часть
|
На поверхности раздела фаз наблюдается различные поверхностные явления.
| | |
| |  |
Фаза – однородная часть гетерогенной системы, которая имеет одинаковый химический состав и одинаковые значения термодинамических параметров.
Границы раздела фаз бывают:
1. подвижные – газ– жидкость и жидкость – жидкость
2. неподвижные газ- – твердое тело, жидкость – твердое тело, твердое тело – твердое тело.
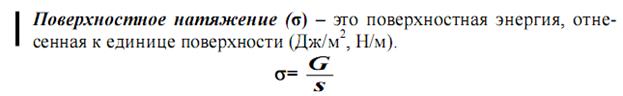
G – свободная поверхностная энергия.
Сорбция и ее виды
Сорбция (от латин. «sorbeo» - поглощаю, втягиваю)– гетерогенный процесс самопроизвольного поглощения твердым телом или жидкостью (сорбентом) веществ (сорбтива) из окружающей среды.
В зависимости от степени прочности связывания сорбтива сорбентом сорбция может быть обратимой и необратимой. Если она является обратимой (что бывает чаще), то в системе устанавливается равновесие

