ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.10.2024
Просмотров: 125
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
4 билетИсточник: https://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/367.html
Гибридизация электронных облаков
Термодинамическая система и ее состояния
Параметры термодинамической системы
Функци состояния термодинамической системы
12. Химическое равновесие. Обратимые и необратимые реакции.
Характеристика растворов. Процесс растворения.
Давление насыщенного пара над раствором. Закон рауля.
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
Лекция по теме «Химические источники тока»
, а только его результат. Событие в термодинамике – это изменение равновесных параметров в ходе термодинамического процесса.
По разным признакам в термодинамике процессы классифицируются так:
Нулевой закон (Нулевое начало) термодинамики – понятие о температуре.
Остановимся на параметре T. Это – абсолютная температура в Кельвинах. Она характеризует среднюю кинетическую энергию хаотического движения, приходящуюся на 1 степень свободы частицы системы:
= ikT
где i – число степеней свободы, k – постоянная Больцмана, - средняя кинетическая энергия хаотического движения.
i= 3 для одноатомных молекул (три направления свободного движения), i=5 (свободное движение плюс два вращения) для двухатомных, i=6 (свободное движение плюс три вращения) для трехатомных и более.
С точки зрения термодинамики температура – особый параметр. Она является индикатором направления передачи тепла – самопроизвольно тепло передается от более горячего тела к более холодному.
Нулевой закон термодинамики гласит:
Две системы, находящиеся в тепловом равновесии с третьей, находятся в равновесии и друг с другом. При этом все три системы характеризуются одинаковым значением определяющего это равенство параметра - температуры.
Сформулирован Ральфом Говардом Фаулером в 1931 году. (1899-1944, Англ. физик, член Лондонского королевского общества, создатель теории нейтронных звезд).
Первый закон (Первое начало) термодинамики. Внутренняя энергия системы и энтальпия.
Сформулируем два понятия, характеризующие механизм передачи энергии от системы к окружающей среде и в обратном направлении.
Теплота (тепло) Q – энергия, передающаяся за счет хаотического движения элементов системы и окружающей среды.
Работа W – энергия, передающаяся за счет упорядоченного поступательного движения потока большого числа элементов системы или окружающей среды.
Ни теплота, ни работа с точки зрения Первого начала термодинамики, не являются функциями состояния системы. Они зависят не только от параметров системы, но и от пути проведения процесса.
Дадим определение внутренней энергии системы U.
Внутренняя энергия системы U – это суммарная энергия всех составных частей системы и их взаимодействий.
Она НЕ ВКЛЮЧАЕТ кинетической и потенциальной энергии системы как целого.
Что же она ВКЛЮЧАЕТ? Это кинетическая энергия хаотического теплового движения частиц системы, потенциальная энергия их взаимодействия, обусловленная структурой системы, энергия электронов на атомных и молекулярных орбиталях, энергия связи в атомных ядрах, энергия элементарных частиц.
В термодинамических процессах изменяются только кинетическая энергия хаотического теплового движения частиц системы, потенциальная энергия их взаимодействия, обусловленная структурой системы и энергия электронов на атомных и молекулярных орбиталях.
Первое начало термодинамики формулируется так:
Тепло, переданное системе, может изменять ее внутреннюю энергию и совершать работу как в системе, так и в окружающей среде:
Q= U+W
Это – одна из формулировок закона сохранения энергии. Она запрещает, в частности, процессы, в которых W 0 при Q= U=0, т.е. получение работы без затраты тепла и изменения внутренней энергии. (Запрет на вечные двигатели первого рода).
В дальнейшем всегда будет пониматься, что (разность) чего бы то ни было, это разность между конечным и начальным состояниями.
Важно также договориться о знаках тепла и работы. В термодинамике знаки рассматриваются с точки зрения системы. То, что «входит» в систему – имеет знак «+», что «покидает» её – знак «-».
Т.е. работа, совершаемая НАД системой положительна (+W), а совершаемая системой НАД окружающей средой – отрицательна (-W).
Аналогично, тепло, поступающее в систему (отнимаемое от окружающей среды в эндотермическом процессе) – положительно (+Q), а тепло, отдаваемое системой (выделяющееся в окружающей среде в экзотермическом процессе) – отрицательно (-Q).
Когда изменение внутренней энергии бесконечно мало, оно является полным дифференциалом внутренней энергии dU, и Первое начало термодинамики записывается в виде:
Q=dU+ W
Здесь введено специальное обозначение для обозначения бесконечно малых изменений тепла и работы, чтобы подчеркнуть, что Q и W являются параметрами пути процесса, а U – параметром состояния системы. Ни тепло, ни работа по отдельности таковыми не являются.
(Полный дифференциал выражается через производные и приращения независимых переменных, в данном случае – параметров системы)
Рассмотрим изобарический процесс P=const. Система переходит из состояния 1 в состояние 2 с тепловым эффектом QP Для него:
Q = QP; U = U2 – U1; W=P(V2 – V1)
Отсюда:
QP = U2 – U1+ P(V2 – V1)=( U2 + PV2) - ( U1 + PV1)
Выражения в скобках являются выражениями новой функции состояния, которая называется энтальпия и обозначается H:
H=U+PV
Из проведенного анализа ясно, что:
QP = H
Т.е. энтальпия – это функция состояния термодинамической системы, определяющая тепловой эффект изобарического процесса.
Энтальпия – экстенсивная и аддитивная функция состояния.
Тепловой эффект реакции. Закон Гесса. Термохимические расчеты.
Тепловым эффектом химической реакции называется количество теплоты, выделяющейся (экзотермические процессы) или поглощающееся (эндотермические процессы) при осуществлении реакции при постоянном давлении или постоянном объёме и равенстве температур начального и конечного состояний системы.
Изучением тепловых эффектов реакций занимается термохимия. Наиболее распространенным является метод работы и расчётов при постоянном давлении. В дальнейшем мы будем говорить только о таких процессах.
В термохимии, в отличие от химической термодинамики, процессы рассматриваются с точки зрения окружающей среды, а потому знаки тепловых эффектов обратные – «+» для экзотермических и «-» для эндотермических процессов. Иными словами:
Qх.р. = - Hх.р. (или Qr = - Hr) Индекс r- от reaction, реакция
При записи стехиометрических уравнений в термохимии обязательно указывается агрегатное состояние реагентов и продуктов реакции, а также тепловой эффект:
2H2Oж + 2Naтв = 2NaOHр-р + H2 г + Qх.р.а ( - Hх.р.а.) (а)
Поскольку энтальпия – функция аддитивная, то при изменении стехиометрических коэффициентов меняется и тепловой эффект химической реакции:
H2Oж + Naтв = NaOHр-р + ½ H2 г + Qх.р.б ( - Hх.р.б.) (б)
И Qх.р.а = 2 Qх.р.б
В термохимии введено важное понятие о теплоте образования химического соединения.
Теплота образования химического соединения – это удельный тепловой эффект реакции образования химического соединения из простых веществ, находящихся в стабильном состоянии при стандартных условиях.
Стандартное состояние – это состояние чистого вещества при давлении 1,013*105Па (1 атм) и определенной температуре (обычно - 298К).
Например, для реакции Cграфит + O2 г. = CO2 + Qх.р, проведенной в стандартных условиях, Qх.р = Qобр. CO2.
В результате большого объёма экспериментальных исследований составлены таблицы теплот образования для огромного количества веществ. Они представлены в виде стандартных энтальпий образования, имеющих вид:
fH0298 A
где индекс f означает formation – образование, индекс 0 – стандартное состояние, 298 – температуру, A –указывает на вещество (скажем, А). Последний индекс часто опускают, вынося указание на формулу вещества в шапку таблицы.
Величина fH0298 имеет размерность кДж/моль и относится к образованию одного моля данного вещества А. Она – величина интенсивная.
Тепловые эффекты химических реакций подчиняются закону Гесса (см. о нем http://ru.wikipedia.org/wiki/%D0%93%D0%B5%D1%81%D1%81%2C_%D0%93%D0%B5%D1%80%D0%BC%D0%B0%D0%BD_%D0%98%D0%B2%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%87 )
Он гласит: тепловой эффект химической реакции определяется только начальным и конечным состоянием реакционной системы и не зависит от пути протекания процесса.
Под путем процесса понимается количество промежуточных реакций.
Так, например, сгорание графита можно провести двумя путями.
Cграфит + O2 г. = CO2 г. + Qх.р.1 (1)
2.Через промежуточное окисление графита до монооксида углерода (угарного газа):
Cграфит + ½ O2 г. = CO г. + Qх.р.2 (2)
CO г. + ½ O2 г. = CO2 г. + Qх.р.3 (3)
В соответствии с законом Гесса, если просуммировать уравнения (2) и (3), и сравнить результат с уравнением (1), мы получим:
Qх.р.2 + Qх.р.3 = Qх.р.1
Закон Гесса позволяет вычислять тепловые эффекты химических реакций, которые сложно осуществить экспериментально, исходя из данных по более простым реакциям.
Важным следствием из закона Гесса является утверждение о том, что тепловой эффект химической реакции может быть вычислен как разность сумм теплот образования продуктов реакции и теплот образования реагентов.
Так, для реакции:
aA + bB = cC + dD + Qх.р.
Hх.р.. = (c fH0298 C + d fH0298 D) – (a fH0298 A + b fH0298 B)
Или: Hх.р. =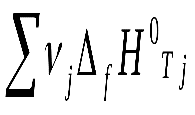 -
- 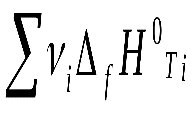
Где - стехиометрические коэффициенты, а индекс i относится к реагентам, а индекс j – к продуктам реакции.
Кроме таблиц (баз данных) по энтальпиям (теплотам) образования химических соединений составлены также (особенно для органических веществ) аналогичные таблицы по теплотам (энтальпиям) сгорания. ( сH0298 A Индекс с – от combustion, сгорание)
Таким образом, мы рассмотрели первую задачу, которую поставили при начале обсуждения темы – задачу об энергетике химических реакций.
На следующей лекции мы рассмотрим вторую задачу – о направлении протекания химических реакций.
Критерием направленности самопроизвольного процесса в случаях изобарно-изотермических или изохорно-изотермических условиях является знак изменения энергии Гиббса G=H-TS или энергии Гельмгольца A=U-TS;
В закрытой системе знак изменения энергии Гиббса является критерием направленности самопроизвольного процесса при проведении его в изобарно-изотермических условиях. При G=0 – система находится в состоянии равновесия, при G<0- процесс протекает в прямом направлении, при G>0 – в обратном. Энергию Гиббса можно расчитать следующим образом: rGт= rHТ - TrSТ. А так же с учетом стехиометрических коэффициентов по формуле: rG=G2–G1
12. Химическое равновесие в закрытых гомогенных системах. Условие равновесия. Константы равновесия. Связь между ними и способы расчета. Параметры, влияющие на состояние равновесия.Принцип Ле Шателье. Применение уравнений «изобары», «изохоры» и «изотермы» химической реакции для анализа смещения равновесия.
Принцип Ле Шателье: Если в системе, находящейся в равновесии, изменить одно из условий этого равновесия, то в ней развиваются процессы, ослабляющие оказываемое воздействие. Химическое равновесие возможно только для кинетически обратимых реакций. Обратимые химические реакции бывают, как гомогенными, так и гетерогенными. Гомогенными называют реакции, протекающие в одной фазе- газовой или жидкой. Они характеризуются отсутсвием поверхности раздела между реагентами и продуктами, взаимодействие которых осуществляется во всем объеме реакционной смеси. При изменении концентрации направление смещения положения равновесия определяется тем, какой из компонентов вводится в равновесную систему, а степень его смещения – стехиометрическим коэффициентам в уравнении. При повышении температуры положение равновесия всегда смещается в напрвлении протекания эндотермической реакции, при понижении – экзотермической. При увеличении давления равновесие смещается в сторону той реакции. которая сопровождается уменьшением объема, а при уменьшении давления – в противоположную.
Одна из важнейших характеристик равновесия-константа равновесия- величина постоянная при данной температуре, давлении и в данном растворителе, равная отношению произведения равновесных активностей продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к аналогичному произведению для исходных веществ в состоянии химического равновесия. Для гомогенных химических равновесий, устанавливающихся в идеальных жидких и газообразных растворах, константу равновесия можно выразить через равновесные молярные концентрации и равновесные молярные доли Kc=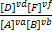 , Kx=
, Kx=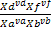 , Kp=
, Kp=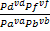 . Взаимосвязь между константами: Кр=Кс(RT)vr , Kp=Kxpvrобщ, Kc=Kx
. Взаимосвязь между константами: Кр=Кс(RT)vr , Kp=Kxpvrобщ, Kc=Kx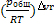 =KxV-vr, V-мольный объем смеси, vr- изменение числа молей, расчитываемое по разности между суммами стехиометрических коэффициентов. Если газофазная реакция протекает без изменения числа молей, то все константы зависят от общего давления в системе, безразмерны и равны между собой.
=KxV-vr, V-мольный объем смеси, vr- изменение числа молей, расчитываемое по разности между суммами стехиометрических коэффициентов. Если газофазная реакция протекает без изменения числа молей, то все константы зависят от общего давления в системе, безразмерны и равны между собой.
Связь между константами равновесия устанавливается уравнениями изотермы, изобары и изохоры Вант-Гоффа.
изотермаВант-Гоффа: ,при стандартных условиях второе слагаемое становится равным нулю.
изобaра Вант-Гоффа: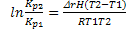
изохора Вант-Гоффа: lnKc= -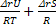
Условия равновесия: сумма химических потенциалов с усетом стехиометрических коэффициентов равна нулю.
13. Химическое равновесие в гетерогенных системах. Правило фаз Гиббса-Коновалова. Термодинамические понятия: фаза, независимый компонент, число степеней свободы (для гомогенных и гетерогенных равновесных систем и реакций). Константа равновесия гетерогенной химической реакции.
В гетерогеннах системах вещества находятся в различных фазах. В таких системах вещества чаще всего взаимодействуют на границе раздела фаз. Химические потенциалы конденсированных веществ, если они не образуют твердых и жидких растворов, не зависит от парциальных давлений и являются в изобарно-изотермических условиях постоянными величинами, равными при стандартных условиях стандартной энергии Гиббса. В выражение константы равновесия для гетерогенной реакции входят парциальные давления, молярные концентрации и изменения числа молей только газообразных компонентов. Если в
реакцию входит только одно твердое вещество, а остальные газы, или только одно газообразное вещество. а остальные в твердых фазах, то необходимо определить температуру равновесия по формуле: Т=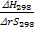 . При увеличении температуры реакция будет протекать в прямом направлении, при уменьшении – в обратном.
. При увеличении температуры реакция будет протекать в прямом направлении, при уменьшении – в обратном.
Правило фаз Гиббса-Коновалова: Число степеней свободы системы равно число компонентов минус число фаз, плюс число минимальных исходных параметров. Числом степеней – число параметров системы, которые можно менять, не изменяя числа и вида фаз системы. По числу степеней свободы системы подразделяются на инвариантные, моновариантные, диваринтные и т.д.
Независимыми компонентами называют составляющие систему вещества, наименьшее число которых необходимо и достаточно для образования и однозначного выражения состава каждой фазы данной системы при любых условиях ее существования.
Число фаз: любое количество газов в реакции образуют одну фазу.
К минимальным исходным параметрам (внешним факторам) относятся: температура, давление, внешние поля. Как правило число внешних параметров равно двум (температура и давление), если какой либо фактор поддерживается постоянным, то число внешних параметров уменьшается.
14. Скорость гомогенной химической реакции. Кинетические кривые. Факторы, влияющие на скорость реакции. Основной постулат химической кинетики (зависимость скорости реакции от концентраций реагирующих веществ). Константа скорости. Порядок реакции и молекулярность.
Скорость гомогенной химической реакции при постоянном объеме представляет собой изменение концентрации данного компонента в единицу времени. Мгновенная скорость реакции: ri=±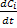 . Скорость реакции положительна, если она определяется по образующемуся в реакции компоненту, и отрицательна, если по расходующемуся, т.е. учитываются разные знаки стехиометрических компонентов Средняя скорость: r
. Скорость реакции положительна, если она определяется по образующемуся в реакции компоненту, и отрицательна, если по расходующемуся, т.е. учитываются разные знаки стехиометрических компонентов Средняя скорость: r
i=±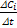 .
.
Под кинетической кривой понимают график зависимости концентрации реагента или продукта реакции от времени. На скорость гомогенной химической реакции могут оказывать влияние следующие факторы: природа реагирующих веществ, концентрации реагирующих веществ, давление, температура, наличие катализаторов или ингибиторов, световое или радиационное излучение.
Основной постулат химической кинетики: Скорость реакции в каждый момент времени при постоянной температуре прямопропорциональна произведению концентраций реагирующих веществ, в степенях, близких к коэффициентам химической реакции: r=kCnaCmb, где k-константа скорости химической реакции. Она численно равна скорости при концентрациях реагирующих веществ, равных единице.Константа скорости зависит от природы реагирующих веществ и от температуры. Скорость образования: rобр=kобрCdvd. Скорость любого многостадийного процесса определяется скоростью самой медленной (лимитирующей) стадией. По значению молекулярности реакции подразделяются на мономолекулярные, бимолекулярные и тримолекулярные. Тетрамолекулярные реакции еще не открыты.
15. Дифференциальные и интегральные уравнения скорости для необратимых реакций нулевого, первого и второго порядков. Период полупревращения. Методы определения порядков реакций.
Реакции нулевого порядка имеют следующие особенности:
Реакции нулевого порядка: С=Со – kt. Константа скорости k=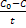 , время полупревращения t=
, время полупревращения t=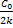 .
.
Реакции первого порядка: lnC=lnCo – k1t. Скорость реакции r1=k1C0е-к1t, Константа скорости: k1=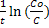 , Время полупревращения t=
, Время полупревращения t=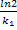 .
.
Реакции второго порядка:
1)В реакции участвуют два реагента с одинаковыми начальными концентрациями: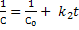
По разным признакам в термодинамике процессы классифицируются так:
-
По конечному результату – разомкнутые и циклические, в результате которых параметры приобретают исходные значения. -
По характеру взаимодействия с окружающей средой: обратимые и необратимые. Обратимые процессы не оставляют изменений в окружающей среде. -
По местонахождению причины: самопроизвольные (причина – в самой системе) и вынужденные (причина – в окружающей среде) -
По пути проведения процесса: изотермический (при постоянной температуре), изобарический или изобарный (при постоянном давлении), изохорический (при постоянном объеме).
Нулевой закон (Нулевое начало) термодинамики – понятие о температуре.
Остановимся на параметре T. Это – абсолютная температура в Кельвинах. Она характеризует среднюю кинетическую энергию хаотического движения, приходящуюся на 1 степень свободы частицы системы:
где i – число степеней свободы, k – постоянная Больцмана,
i= 3 для одноатомных молекул (три направления свободного движения), i=5 (свободное движение плюс два вращения) для двухатомных, i=6 (свободное движение плюс три вращения) для трехатомных и более.
С точки зрения термодинамики температура – особый параметр. Она является индикатором направления передачи тепла – самопроизвольно тепло передается от более горячего тела к более холодному.
Нулевой закон термодинамики гласит:
Две системы, находящиеся в тепловом равновесии с третьей, находятся в равновесии и друг с другом. При этом все три системы характеризуются одинаковым значением определяющего это равенство параметра - температуры.
Сформулирован Ральфом Говардом Фаулером в 1931 году. (1899-1944, Англ. физик, член Лондонского королевского общества, создатель теории нейтронных звезд).
Первый закон (Первое начало) термодинамики. Внутренняя энергия системы и энтальпия.
Сформулируем два понятия, характеризующие механизм передачи энергии от системы к окружающей среде и в обратном направлении.
Теплота (тепло) Q – энергия, передающаяся за счет хаотического движения элементов системы и окружающей среды.
Работа W – энергия, передающаяся за счет упорядоченного поступательного движения потока большого числа элементов системы или окружающей среды.
Ни теплота, ни работа с точки зрения Первого начала термодинамики, не являются функциями состояния системы. Они зависят не только от параметров системы, но и от пути проведения процесса.
Дадим определение внутренней энергии системы U.
Внутренняя энергия системы U – это суммарная энергия всех составных частей системы и их взаимодействий.
Она НЕ ВКЛЮЧАЕТ кинетической и потенциальной энергии системы как целого.
Что же она ВКЛЮЧАЕТ? Это кинетическая энергия хаотического теплового движения частиц системы, потенциальная энергия их взаимодействия, обусловленная структурой системы, энергия электронов на атомных и молекулярных орбиталях, энергия связи в атомных ядрах, энергия элементарных частиц.
В термодинамических процессах изменяются только кинетическая энергия хаотического теплового движения частиц системы, потенциальная энергия их взаимодействия, обусловленная структурой системы и энергия электронов на атомных и молекулярных орбиталях.
Первое начало термодинамики формулируется так:
Тепло, переданное системе, может изменять ее внутреннюю энергию и совершать работу как в системе, так и в окружающей среде:
Q= U+W
Это – одна из формулировок закона сохранения энергии. Она запрещает, в частности, процессы, в которых W 0 при Q= U=0, т.е. получение работы без затраты тепла и изменения внутренней энергии. (Запрет на вечные двигатели первого рода).
В дальнейшем всегда будет пониматься, что (разность) чего бы то ни было, это разность между конечным и начальным состояниями.
Важно также договориться о знаках тепла и работы. В термодинамике знаки рассматриваются с точки зрения системы. То, что «входит» в систему – имеет знак «+», что «покидает» её – знак «-».
Т.е. работа, совершаемая НАД системой положительна (+W), а совершаемая системой НАД окружающей средой – отрицательна (-W).
Аналогично, тепло, поступающее в систему (отнимаемое от окружающей среды в эндотермическом процессе) – положительно (+Q), а тепло, отдаваемое системой (выделяющееся в окружающей среде в экзотермическом процессе) – отрицательно (-Q).
Когда изменение внутренней энергии бесконечно мало, оно является полным дифференциалом внутренней энергии dU, и Первое начало термодинамики записывается в виде:
Q=dU+ W
Здесь введено специальное обозначение для обозначения бесконечно малых изменений тепла и работы, чтобы подчеркнуть, что Q и W являются параметрами пути процесса, а U – параметром состояния системы. Ни тепло, ни работа по отдельности таковыми не являются.
(Полный дифференциал выражается через производные и приращения независимых переменных, в данном случае – параметров системы)
Рассмотрим изобарический процесс P=const. Система переходит из состояния 1 в состояние 2 с тепловым эффектом QP Для него:
Q = QP; U = U2 – U1; W=P(V2 – V1)
Отсюда:
QP = U2 – U1+ P(V2 – V1)=( U2 + PV2) - ( U1 + PV1)
Выражения в скобках являются выражениями новой функции состояния, которая называется энтальпия и обозначается H:
H=U+PV
Из проведенного анализа ясно, что:
QP = H
Т.е. энтальпия – это функция состояния термодинамической системы, определяющая тепловой эффект изобарического процесса.
Энтальпия – экстенсивная и аддитивная функция состояния.
Тепловой эффект реакции. Закон Гесса. Термохимические расчеты.
Тепловым эффектом химической реакции называется количество теплоты, выделяющейся (экзотермические процессы) или поглощающееся (эндотермические процессы) при осуществлении реакции при постоянном давлении или постоянном объёме и равенстве температур начального и конечного состояний системы.
Изучением тепловых эффектов реакций занимается термохимия. Наиболее распространенным является метод работы и расчётов при постоянном давлении. В дальнейшем мы будем говорить только о таких процессах.
В термохимии, в отличие от химической термодинамики, процессы рассматриваются с точки зрения окружающей среды, а потому знаки тепловых эффектов обратные – «+» для экзотермических и «-» для эндотермических процессов. Иными словами:
Qх.р. = - Hх.р. (или Qr = - Hr) Индекс r- от reaction, реакция
При записи стехиометрических уравнений в термохимии обязательно указывается агрегатное состояние реагентов и продуктов реакции, а также тепловой эффект:
2H2Oж + 2Naтв = 2NaOHр-р + H2 г + Qх.р.а ( - Hх.р.а.) (а)
Поскольку энтальпия – функция аддитивная, то при изменении стехиометрических коэффициентов меняется и тепловой эффект химической реакции:
H2Oж + Naтв = NaOHр-р + ½ H2 г + Qх.р.б ( - Hх.р.б.) (б)
И Qх.р.а = 2 Qх.р.б
В термохимии введено важное понятие о теплоте образования химического соединения.
Теплота образования химического соединения – это удельный тепловой эффект реакции образования химического соединения из простых веществ, находящихся в стабильном состоянии при стандартных условиях.
Стандартное состояние – это состояние чистого вещества при давлении 1,013*105Па (1 атм) и определенной температуре (обычно - 298К).
Например, для реакции Cграфит + O2 г. = CO2 + Qх.р, проведенной в стандартных условиях, Qх.р = Qобр. CO2.
В результате большого объёма экспериментальных исследований составлены таблицы теплот образования для огромного количества веществ. Они представлены в виде стандартных энтальпий образования, имеющих вид:
fH0298 A
где индекс f означает formation – образование, индекс 0 – стандартное состояние, 298 – температуру, A –указывает на вещество (скажем, А). Последний индекс часто опускают, вынося указание на формулу вещества в шапку таблицы.
Величина fH0298 имеет размерность кДж/моль и относится к образованию одного моля данного вещества А. Она – величина интенсивная.
Тепловые эффекты химических реакций подчиняются закону Гесса (см. о нем http://ru.wikipedia.org/wiki/%D0%93%D0%B5%D1%81%D1%81%2C_%D0%93%D0%B5%D1%80%D0%BC%D0%B0%D0%BD_%D0%98%D0%B2%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%87 )
Он гласит: тепловой эффект химической реакции определяется только начальным и конечным состоянием реакционной системы и не зависит от пути протекания процесса.
Под путем процесса понимается количество промежуточных реакций.
Так, например, сгорание графита можно провести двумя путями.
-
Прямое взаимодействие:
Cграфит + O2 г. = CO2 г. + Qх.р.1 (1)
2.Через промежуточное окисление графита до монооксида углерода (угарного газа):
Cграфит + ½ O2 г. = CO г. + Qх.р.2 (2)
CO г. + ½ O2 г. = CO2 г. + Qх.р.3 (3)
В соответствии с законом Гесса, если просуммировать уравнения (2) и (3), и сравнить результат с уравнением (1), мы получим:
Qх.р.2 + Qх.р.3 = Qх.р.1
Закон Гесса позволяет вычислять тепловые эффекты химических реакций, которые сложно осуществить экспериментально, исходя из данных по более простым реакциям.
Важным следствием из закона Гесса является утверждение о том, что тепловой эффект химической реакции может быть вычислен как разность сумм теплот образования продуктов реакции и теплот образования реагентов.
Так, для реакции:
aA + bB = cC + dD + Qх.р.
Hх.р.. = (c fH0298 C + d fH0298 D) – (a fH0298 A + b fH0298 B)
Или: Hх.р. =
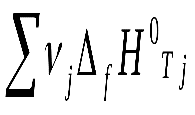 -
- 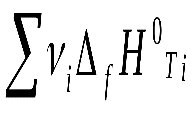
Где - стехиометрические коэффициенты, а индекс i относится к реагентам, а индекс j – к продуктам реакции.
Кроме таблиц (баз данных) по энтальпиям (теплотам) образования химических соединений составлены также (особенно для органических веществ) аналогичные таблицы по теплотам (энтальпиям) сгорания. ( сH0298 A Индекс с – от combustion, сгорание)
Таким образом, мы рассмотрели первую задачу, которую поставили при начале обсуждения темы – задачу об энергетике химических реакций.
На следующей лекции мы рассмотрим вторую задачу – о направлении протекания химических реакций.
20 билет
Термодинамические функции состояния: энергия Гиббса и энергия Гельмгольца. Критерии самопроизвольного протекания процессов. Способы расчета изменеия энергии Гиббса в ходе химической реакции.
Критерием направленности самопроизвольного процесса в случаях изобарно-изотермических или изохорно-изотермических условиях является знак изменения энергии Гиббса G=H-TS или энергии Гельмгольца A=U-TS;
В закрытой системе знак изменения энергии Гиббса является критерием направленности самопроизвольного процесса при проведении его в изобарно-изотермических условиях. При G=0 – система находится в состоянии равновесия, при G<0- процесс протекает в прямом направлении, при G>0 – в обратном. Энергию Гиббса можно расчитать следующим образом: rGт= rHТ - TrSТ. А так же с учетом стехиометрических коэффициентов по формуле: rG=G2–G1
12. Химическое равновесие в закрытых гомогенных системах. Условие равновесия. Константы равновесия. Связь между ними и способы расчета. Параметры, влияющие на состояние равновесия.Принцип Ле Шателье. Применение уравнений «изобары», «изохоры» и «изотермы» химической реакции для анализа смещения равновесия.
Принцип Ле Шателье: Если в системе, находящейся в равновесии, изменить одно из условий этого равновесия, то в ней развиваются процессы, ослабляющие оказываемое воздействие. Химическое равновесие возможно только для кинетически обратимых реакций. Обратимые химические реакции бывают, как гомогенными, так и гетерогенными. Гомогенными называют реакции, протекающие в одной фазе- газовой или жидкой. Они характеризуются отсутсвием поверхности раздела между реагентами и продуктами, взаимодействие которых осуществляется во всем объеме реакционной смеси. При изменении концентрации направление смещения положения равновесия определяется тем, какой из компонентов вводится в равновесную систему, а степень его смещения – стехиометрическим коэффициентам в уравнении. При повышении температуры положение равновесия всегда смещается в напрвлении протекания эндотермической реакции, при понижении – экзотермической. При увеличении давления равновесие смещается в сторону той реакции. которая сопровождается уменьшением объема, а при уменьшении давления – в противоположную.
Одна из важнейших характеристик равновесия-константа равновесия- величина постоянная при данной температуре, давлении и в данном растворителе, равная отношению произведения равновесных активностей продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к аналогичному произведению для исходных веществ в состоянии химического равновесия. Для гомогенных химических равновесий, устанавливающихся в идеальных жидких и газообразных растворах, константу равновесия можно выразить через равновесные молярные концентрации и равновесные молярные доли Kc=
Связь между константами равновесия устанавливается уравнениями изотермы, изобары и изохоры Вант-Гоффа.
изотермаВант-Гоффа: ,при стандартных условиях второе слагаемое становится равным нулю.
изобaра Вант-Гоффа:
изохора Вант-Гоффа: lnKc= -
Условия равновесия: сумма химических потенциалов с усетом стехиометрических коэффициентов равна нулю.
13. Химическое равновесие в гетерогенных системах. Правило фаз Гиббса-Коновалова. Термодинамические понятия: фаза, независимый компонент, число степеней свободы (для гомогенных и гетерогенных равновесных систем и реакций). Константа равновесия гетерогенной химической реакции.
В гетерогеннах системах вещества находятся в различных фазах. В таких системах вещества чаще всего взаимодействуют на границе раздела фаз. Химические потенциалы конденсированных веществ, если они не образуют твердых и жидких растворов, не зависит от парциальных давлений и являются в изобарно-изотермических условиях постоянными величинами, равными при стандартных условиях стандартной энергии Гиббса. В выражение константы равновесия для гетерогенной реакции входят парциальные давления, молярные концентрации и изменения числа молей только газообразных компонентов. Если в
реакцию входит только одно твердое вещество, а остальные газы, или только одно газообразное вещество. а остальные в твердых фазах, то необходимо определить температуру равновесия по формуле: Т=
Правило фаз Гиббса-Коновалова: Число степеней свободы системы равно число компонентов минус число фаз, плюс число минимальных исходных параметров. Числом степеней – число параметров системы, которые можно менять, не изменяя числа и вида фаз системы. По числу степеней свободы системы подразделяются на инвариантные, моновариантные, диваринтные и т.д.
Независимыми компонентами называют составляющие систему вещества, наименьшее число которых необходимо и достаточно для образования и однозначного выражения состава каждой фазы данной системы при любых условиях ее существования.
Число фаз: любое количество газов в реакции образуют одну фазу.
К минимальным исходным параметрам (внешним факторам) относятся: температура, давление, внешние поля. Как правило число внешних параметров равно двум (температура и давление), если какой либо фактор поддерживается постоянным, то число внешних параметров уменьшается.
14. Скорость гомогенной химической реакции. Кинетические кривые. Факторы, влияющие на скорость реакции. Основной постулат химической кинетики (зависимость скорости реакции от концентраций реагирующих веществ). Константа скорости. Порядок реакции и молекулярность.
Скорость гомогенной химической реакции при постоянном объеме представляет собой изменение концентрации данного компонента в единицу времени. Мгновенная скорость реакции: ri=±
i=±
Под кинетической кривой понимают график зависимости концентрации реагента или продукта реакции от времени. На скорость гомогенной химической реакции могут оказывать влияние следующие факторы: природа реагирующих веществ, концентрации реагирующих веществ, давление, температура, наличие катализаторов или ингибиторов, световое или радиационное излучение.
Основной постулат химической кинетики: Скорость реакции в каждый момент времени при постоянной температуре прямопропорциональна произведению концентраций реагирующих веществ, в степенях, близких к коэффициентам химической реакции: r=kCnaCmb, где k-константа скорости химической реакции. Она численно равна скорости при концентрациях реагирующих веществ, равных единице.Константа скорости зависит от природы реагирующих веществ и от температуры. Скорость образования: rобр=kобрCdvd. Скорость любого многостадийного процесса определяется скоростью самой медленной (лимитирующей) стадией. По значению молекулярности реакции подразделяются на мономолекулярные, бимолекулярные и тримолекулярные. Тетрамолекулярные реакции еще не открыты.
15. Дифференциальные и интегральные уравнения скорости для необратимых реакций нулевого, первого и второго порядков. Период полупревращения. Методы определения порядков реакций.
Реакции нулевого порядка имеют следующие особенности:
Реакции нулевого порядка: С=Со – kt. Константа скорости k=
Реакции первого порядка: lnC=lnCo – k1t. Скорость реакции r1=k1C0е-к1t, Константа скорости: k1=
Реакции второго порядка:
1)В реакции участвуют два реагента с одинаковыми начальными концентрациями:

