ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.10.2024
Просмотров: 132
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
4 билетИсточник: https://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/367.html
Гибридизация электронных облаков
Термодинамическая система и ее состояния
Параметры термодинамической системы
Функци состояния термодинамической системы
12. Химическое равновесие. Обратимые и необратимые реакции.
Характеристика растворов. Процесс растворения.
Давление насыщенного пара над раствором. Закон рауля.
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
Лекция по теме «Химические источники тока»
. Ионны в кристале упаковываются таким образом, чтобы одноименные находились как можно дальше (мин отталкивались), а различные как можно ближн (мах притяжение).
По этой причине ионные кристалы характерезуются принципом плотнейшей упаковки.
Вокруг каждого ионна может располагаться ограниченное число противо-ионнов.
Это число называется координационным чилом (к.ч.) f (rкатион/rанион).
2. В ионном кристале нельзя выделить реально существующую структурную единицу (молекулу). Молекула для ионного вещества – условная формульная единица. Она лишь показывает соотношение кол-ва катионов и анионов в макрокристале вещества. NaCl AlCl3
1:1 1:3
Свойства веществ с ионной связью
1) Прочные и Твердые, Есв = 500÷1000 кДж/моль;
2) Хрупкие - не выдерживают воздействий, приводящих к смещению ионных слоев;
3) Не проводят эл ток и тепло (с твердом состоянии), т.к нет свободных электронов

Примеры веществ с ионной связью.
К веществам с ионной связью относятся все соли, образованные органически и неорганически,
соединения между наиболее активными Ме и НеМе,
Если НеМе более активен чем Ме => между ними ионная связь.
Ионная связь образуется в том случае, когда валентный электрон от одного атома переходит к другому. А в результате образуются два иона. Но для этого нужно, чтобы один из атомов был типичный неметалл, а другой типичный металл. И больше всего подходят к этому случаю соединения сильных неметаллов и щелочных металлов. А конкретно из пояснения для ответа подходит NaF. Именно здесь фтор является сильным электроотрицательным элементом, и он присоединяет к себе электрон от натрия. А именно натрий легко отдает электрон и становится положительным ионом.

CH4 - ковалентная полярная; валентность углерода = IV, валентность водорода = I; степень окисления углерода -4, водорода +1

Хлорид натрия образует кристаллы с кубической симметрией. Более крупные ионы хлора образуют плотную кубическую упаковку, в свободных узлах которой (в вершинах правильного октаэдра) расположены ионы натрия. Вид связи в кристалле хлорида натрия – ионная, в кристалле натрия – металлическая. Для веществ с металлической связью образуется металлическая кристаллическая решетка (в узлах КР находятся атом-ионы натрия, а между ними располагаются делокализованные общие электроны, принадлежащие сразу всем атом-ионам - электронный газ). В случае металлического натрия кристаллическая решетка кубическая гранецентрированная. Вещества с ионной химической связью обладают ионной кристаллической решеткой (в узлах находятся ионы Na⁺ и Cl⁻, при этом они чередуются между собой через один). Тип кристаллической решетки в этом случае кубическая. Таким образом один атом натрия в обоих случаях координирует 8 соседних частиц. Значит, координационное число натрия равно 8.
Наиболее типичны металлы, в которых валентная зона заполнена не нацело. Таковы щелочные и щелочноземельные металлы, у которых р-состояния валентной оболочки полностью или частично свободны. И в этом случае зона проводимости может перекрываться с валентной зоной, и тогда даже при самых низких температурах электроны коллективизируются всем кристаллом и передвигаются по свободным квантовым состояниям зоны проводимости при наложении электрического поля, что приводит к высокой электропроводности таких металлов.
Коллективизацию электронов в металлическом кристалле часто представляют следующим образом: положительно заряженные остовы атомов «плавают» или, точнее, «висят» в отрицательно заряженной «электронной жидкости» (модель «желе»), оставаясь, однако, в узлах кристаллической решетки. Поэтому структура типичного металла не обнаруживает признаков направленности связи и либо подчиняется законам плотнейших упаковок, либо приближается к ним. Действительно, из 60 типичных металлов Периодической Системы 40 кристаллизуются в плотнейших кубической (рис. 39 а, б) или гексагональной (рис. 39 д, е) структурах с КЧ=12, а еще 15 - в объемноцентрированной кубической с КЧ=8+6, которая приближается к первым по компактности упаковки (68% по сравнению с 74%) (рис. 39 в, г). Расстояние до шести вторых соседей только на 15% больше расстояния до восьми первых в ОЦК-структуре.
Ненаправленность связей от данного атома к его ближайшим соседям сближает структуры металлов со структурами ионных кристаллов, где кулоновские силы между соседями также имеют центральный характер, т.е. сферическую симметрию.
Поэтому вторые соседи, т.е. одноименные ионы, обычно анионы, образуют в ионных кристаллах те же плотнейшие упаковки. Разница, однако, состоит в том, что в
ионных кристаллах ближайшие соседи разного знака (катионы и анионы) имеют различные размеры и поэтому разнообразие структур ионных кристаллов гораздо больше, чем металлических, и не сводится к трем плотнейшим и плотным упаковкам.
Переходные металлы также, как правило, обладают типичными металлическими свойствами (электро- и теплопроводность, ковкость и т. п.) и структурами, которые описываются одной из плотнейших или плотных упаковок. Но существует группа простых веществ, свойства которых указывают на их переходный характер между чисто металлическими и чисто ковалентными соединениями (полуметаллы, металлоиды). Очень сложными структурами обладают кубические полиморфные модификации β-W, α- и β-Mn (α-W имеет ОЦК, γ-Mn – ГЦК-структуры). В структуре
β-W разные атомы W имеют КЧ 12 и 14. В структуре α-Mn существуют четыре, а в структуре β-Mn – два сорта атомов Mn, отличающихся по координации и размерам. Это можно объяснить различным электронным строением (валентным состоянием) кристаллохимически различных сортов атомов.
Полярность ковалентной связи оценивается количественно при помощи дипольного момента (µ), при этом система из двух равнозначных, но противоположных по знаку, зарядов, называется диполем.
Очень важно различать дипольный момент ковалентной связи (ее полярность) и дипольный момент молекулы в целом. В простых двухатомных молекулах эти два параметра равны между собой
Дипольный момент связи (m) - векторная величина, характеризующая полярность связи.
Длина вектора равна произведению длины связи l на эффективный заряд q, который приобретают атомы при смещении электронной плотности: | m | = lЧ q. Вектор дипольного момента направлен от положительного заряда к отрицательному. При векторном сложении дипольных моментов всех связей получают дипольный момент молекулы.
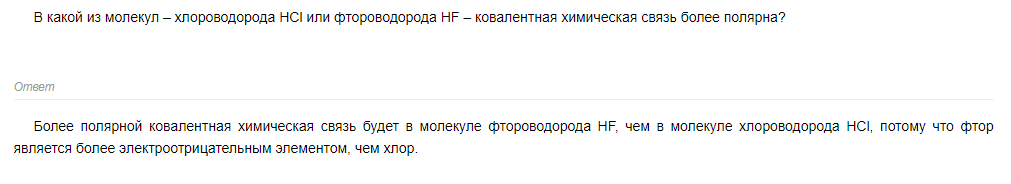
HF
Потому что F - самый электроотрицательный элемент
По этой причине ионные кристалы характерезуются принципом плотнейшей упаковки.
Вокруг каждого ионна может располагаться ограниченное число противо-ионнов.
Это число называется координационным чилом (к.ч.) f (rкатион/rанион).
2. В ионном кристале нельзя выделить реально существующую структурную единицу (молекулу). Молекула для ионного вещества – условная формульная единица. Она лишь показывает соотношение кол-ва катионов и анионов в макрокристале вещества. NaCl AlCl3
1:1 1:3
Свойства веществ с ионной связью
1) Прочные и Твердые, Есв = 500÷1000 кДж/моль;
2) Хрупкие - не выдерживают воздействий, приводящих к смещению ионных слоев;
3) Не проводят эл ток и тепло (с твердом состоянии), т.к нет свободных электронов
Примеры веществ с ионной связью.
К веществам с ионной связью относятся все соли, образованные органически и неорганически,
соединения между наиболее активными Ме и НеМе,
Если НеМе более активен чем Ме => между ними ионная связь.
Ионная связь образуется в том случае, когда валентный электрон от одного атома переходит к другому. А в результате образуются два иона. Но для этого нужно, чтобы один из атомов был типичный неметалл, а другой типичный металл. И больше всего подходят к этому случаю соединения сильных неметаллов и щелочных металлов. А конкретно из пояснения для ответа подходит NaF. Именно здесь фтор является сильным электроотрицательным элементом, и он присоединяет к себе электрон от натрия. А именно натрий легко отдает электрон и становится положительным ионом.
14 билет

CH4 - ковалентная полярная; валентность углерода = IV, валентность водорода = I; степень окисления углерода -4, водорода +1
15 билет

16 билет
Хлорид натрия образует кристаллы с кубической симметрией. Более крупные ионы хлора образуют плотную кубическую упаковку, в свободных узлах которой (в вершинах правильного октаэдра) расположены ионы натрия. Вид связи в кристалле хлорида натрия – ионная, в кристалле натрия – металлическая. Для веществ с металлической связью образуется металлическая кристаллическая решетка (в узлах КР находятся атом-ионы натрия, а между ними располагаются делокализованные общие электроны, принадлежащие сразу всем атом-ионам - электронный газ). В случае металлического натрия кристаллическая решетка кубическая гранецентрированная. Вещества с ионной химической связью обладают ионной кристаллической решеткой (в узлах находятся ионы Na⁺ и Cl⁻, при этом они чередуются между собой через один). Тип кристаллической решетки в этом случае кубическая. Таким образом один атом натрия в обоих случаях координирует 8 соседних частиц. Значит, координационное число натрия равно 8.
Наиболее типичны металлы, в которых валентная зона заполнена не нацело. Таковы щелочные и щелочноземельные металлы, у которых р-состояния валентной оболочки полностью или частично свободны. И в этом случае зона проводимости может перекрываться с валентной зоной, и тогда даже при самых низких температурах электроны коллективизируются всем кристаллом и передвигаются по свободным квантовым состояниям зоны проводимости при наложении электрического поля, что приводит к высокой электропроводности таких металлов.
Коллективизацию электронов в металлическом кристалле часто представляют следующим образом: положительно заряженные остовы атомов «плавают» или, точнее, «висят» в отрицательно заряженной «электронной жидкости» (модель «желе»), оставаясь, однако, в узлах кристаллической решетки. Поэтому структура типичного металла не обнаруживает признаков направленности связи и либо подчиняется законам плотнейших упаковок, либо приближается к ним. Действительно, из 60 типичных металлов Периодической Системы 40 кристаллизуются в плотнейших кубической (рис. 39 а, б) или гексагональной (рис. 39 д, е) структурах с КЧ=12, а еще 15 - в объемноцентрированной кубической с КЧ=8+6, которая приближается к первым по компактности упаковки (68% по сравнению с 74%) (рис. 39 в, г). Расстояние до шести вторых соседей только на 15% больше расстояния до восьми первых в ОЦК-структуре.
Ненаправленность связей от данного атома к его ближайшим соседям сближает структуры металлов со структурами ионных кристаллов, где кулоновские силы между соседями также имеют центральный характер, т.е. сферическую симметрию.
Поэтому вторые соседи, т.е. одноименные ионы, обычно анионы, образуют в ионных кристаллах те же плотнейшие упаковки. Разница, однако, состоит в том, что в
ионных кристаллах ближайшие соседи разного знака (катионы и анионы) имеют различные размеры и поэтому разнообразие структур ионных кристаллов гораздо больше, чем металлических, и не сводится к трем плотнейшим и плотным упаковкам.
Переходные металлы также, как правило, обладают типичными металлическими свойствами (электро- и теплопроводность, ковкость и т. п.) и структурами, которые описываются одной из плотнейших или плотных упаковок. Но существует группа простых веществ, свойства которых указывают на их переходный характер между чисто металлическими и чисто ковалентными соединениями (полуметаллы, металлоиды). Очень сложными структурами обладают кубические полиморфные модификации β-W, α- и β-Mn (α-W имеет ОЦК, γ-Mn – ГЦК-структуры). В структуре
β-W разные атомы W имеют КЧ 12 и 14. В структуре α-Mn существуют четыре, а в структуре β-Mn – два сорта атомов Mn, отличающихся по координации и размерам. Это можно объяснить различным электронным строением (валентным состоянием) кристаллохимически различных сортов атомов.
17 билет
Полярность ковалентной связи оценивается количественно при помощи дипольного момента (µ), при этом система из двух равнозначных, но противоположных по знаку, зарядов, называется диполем.
Очень важно различать дипольный момент ковалентной связи (ее полярность) и дипольный момент молекулы в целом. В простых двухатомных молекулах эти два параметра равны между собой
Дипольный момент связи (m) - векторная величина, характеризующая полярность связи.
Длина вектора равна произведению длины связи l на эффективный заряд q, который приобретают атомы при смещении электронной плотности: | m | = lЧ q. Вектор дипольного момента направлен от положительного заряда к отрицательному. При векторном сложении дипольных моментов всех связей получают дипольный момент молекулы.

HF
Потому что F - самый электроотрицательный элемент

