ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.10.2024
Просмотров: 98
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
4 билетИсточник: https://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/367.html
Гибридизация электронных облаков
Термодинамическая система и ее состояния
Параметры термодинамической системы
Функци состояния термодинамической системы
12. Химическое равновесие. Обратимые и необратимые реакции.
Характеристика растворов. Процесс растворения.
Давление насыщенного пара над раствором. Закон рауля.
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
Лекция по теме «Химические источники тока»
8 билет
В зависимости от типов атомов, образующих химическую связь, выделяют и типы химической связи: ковалентную, ионную, металлическую и др.
Химическая связь возникает благодаря взаимодействию электрических полей, создаваемых электронами и ядрами атомов, участвующих в образовании молекулы или кристалла. Химическая связь образуется, если электроны взаимодействующих атомов получают возможность двигаться одновременно вблизи положительных зарядов нескольких ядер.
Химическая связь между атомами, осуществляемая обобществленными электронами, называется ковалентной связью. Ковалентная связь существует между атомами как в молекулах, так и в кристаллах. Характерными особенностями ковалентной связи являются её насыщаемость и направленность. Насыщаемость ковалентных связей обусловлена тем, что в химическом взаимодействии участвуют электроны только внешних энергетических уровней, т. е. ограниченное число электронов.
Особенности КС:
-
Прочность КС – это свойства характер длинной связи (межъядерное пространство) и энергии энергией связи. -
Полярность КС. В молекулах, содержащих ядра атомов одного и того же элемента, одна или несколько пар электронов в равной мере принадлежат обоим атомам, каждое ядро атома с одинаковой силой притягивает пару связывающих электронов. Такая связь называется неполярной ковалентной связью.
Если пара электронов, образующих химическую связь, смещена к одному из ядер атомов, то связь называют полярной ковалентной связью.
-
Насыщаемость КС – это способность атома участвовать только в определенном числе КС, насыщаемость характеризует валентностью атома. Количественные меры валентности явл. число не спаренных электронов у атома в основном и в возбужденном состоянии. -
Направленность КС. Наиболее прочные КС образуются в направлении максимального перекрывания атомных орбиталей, т.е. мерой направленности служит валентный угол. -
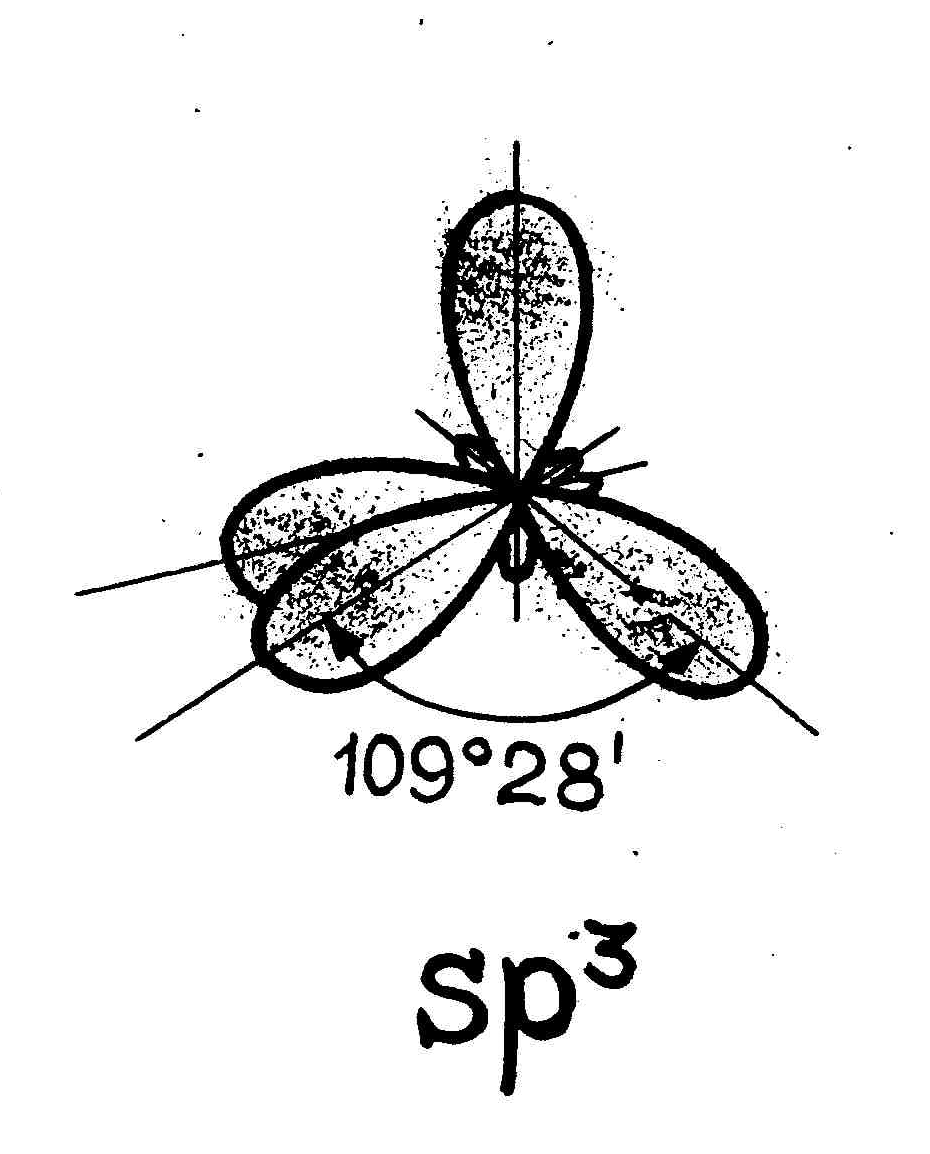
Гибридизация КС – при гибридизации происходит смещение атомных орбиталей, т.е. происходит выравнивание по энергии и по форме. Существует sp, sp2, sp3 –гибридизация. sp – форма молекулы линейная (угол 1800), sp2 – форма молекулы плоская треугольная (угол 1200), sp3 - форма тетраэдрическая (угол 109028). -
Кратность КС или делоколизация связи – Число связей, образующихся между атомами, называется кратностью (порядком) связи. С увеличением кратности (порядка) связи изменяется длина связи и ее энергия.
Открой таблицу Менделеева и найди фтор F и франций Fr. Чем металл ближе к францию, а неметалл ближе к фтору, тем ближе связь к ионной!
Ионная связь образуется между элементами имеющие разную электроотрицательности. Литий щелочной металл, фтор самый электроотрицательный элемент. Связь между литием и фтором будет самой ионной.
9 билет
Гибридизация электронных облаков
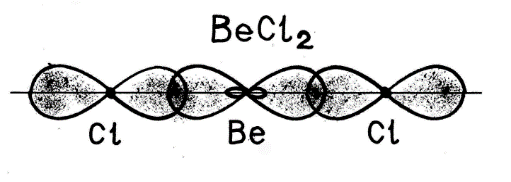
Часто атомы формируют свои связи за счет электронов различных подуровней. Рассмотрим пример образования молекулы BeCl2 .
В нормальном состоянии бериллий не может принимать участие в образовании химических связей в связи с отсутствием неспаренных электронов. Но так как у бериллия есть свободный p-подуровень, возможен переход атома в возбужденное состояние, которое характеризуется распариванием электронов и переходом одного их них с s- на p-подуровень.
| | | | | | | ||
| s | | p | | | |||
| ↓↑ |
Имея два неспаренных электрона, атом бериллия способен к образованию двух связей по обменному механизму.
Образующиеся связи должны быть разными по энергии, так как электроны находятся на разных подуровнях. Однако экспериментально доказано, что обе связи совершенно одинаковы. Следовательно, при образовании химических связей происходит выравнивание атомных орбиталей по энергии и форме. Этот процесс получил название – гибридизация, а «выровненные» орбитали называют гибридными.
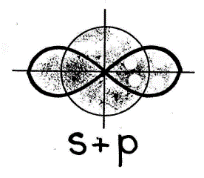
Случай гибридизации одной s- и одной p- орбитали называется sp-гибридизацией.
Для sp-гибридизации характерна линейная структура молекулы, валентный угол 180°.Такой вид гибридизации наблюдается у элементов II группы.
Например: молекула хлорида бериллия BeCl2 - атом бериллия для образования двух связей с атомами хлора переходит в возбужденное состояние (как показано выше). В результате электронные облака одного
s-(сферической формы) и одного р-электрона (имеющего форму объемной восьмерки) подвергаются sр-гибридизации, в результате которой образуются два гибридных облака, располагающихся в пространстве под углом 1800:
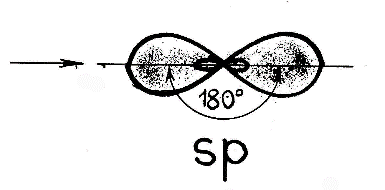
У каждого из двух атомов хлора не происходит гибридизации, так как имеется по одному необходимому неспаренному электрону (так как электрон находится на р-подуровне, форма его электронного облака - объемная восьмерка) для образования связи с бериллием:
| ↑↓ | ↑↓ | ↑↓ | ↓ |
17Cl:… 3s2 3p5:
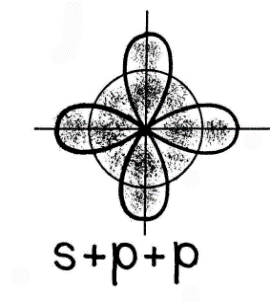
При гибридизации одной s- и двух p- орбиталей (sp2-гибридизация) образуются три равноценные гибридные орбитали, которые располагаются под углом 1200 в одной плоскости. Такая гибридизация характерна для элементов III группы.
На
 пример: молекула хлорида бораBCl3 5B→2s2 2p1 5B*→2s12p2
пример: молекула хлорида бораBCl3 5B→2s2 2p1 5B*→2s12p2| | ↓ | | | | |
| s | | p | | | |
| | | | | ↑ | |
| s | | p | | | |

В
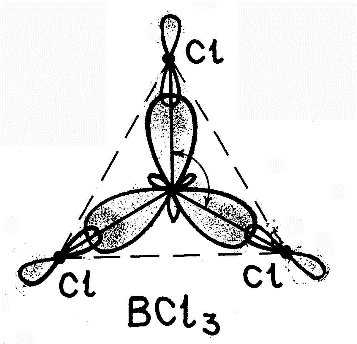 sp3-гибридизация участвуют одна s- и три p- орбитали, в результате образуются четыре гибридные орбитали. Данный тип гибридизации характерен для элементов IV группы.
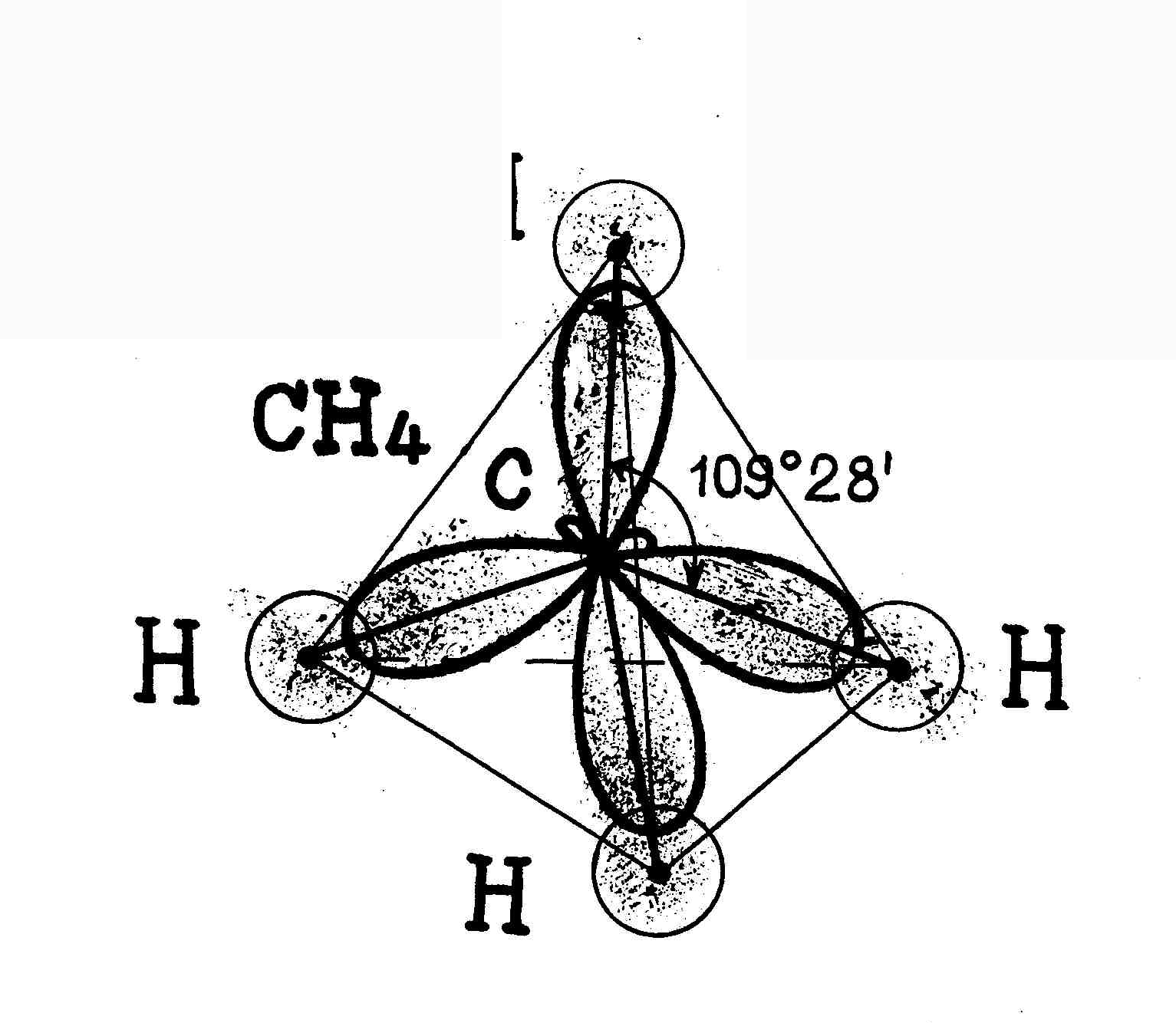
sp3-гибридизация участвуют одна s- и три p- орбитали, в результате образуются четыре гибридные орбитали. Данный тип гибридизации характерен для элементов IV группы.Например: молекула метана CH4 6C : 2s2 2p2 → С*:2s12p3
ковалентность = 2 ковалентность = 4
| | ↓ | | | ↑ | |
| s | | p | | |
| | | | | ↑ | ↑ |
| s | | p | | |

 аким образом, основные положения теории гибридизации:
аким образом, основные положения теории гибридизации: -
В гибридизации участвуют орбитали разных подуровней одного уровня. -
Число гибридных орбиталей равно числу чистых орбиталей, участвующих в гибридизации. -
Гибридные орбитали более вытянуты в направлении образования химических связей и поэтому обеспечивают лучшее перекрывание электронных облаков.
Какие типы гибридизации АО углерода соответствуют образованию молекул СН4, С2Н6, С2Н4, С2Н2?
Решение:
а) В молекулах СН4 и С2Н6 валентный электронный слой атома углерода содержит четыре электронных пары:
-
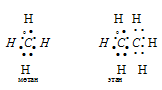
-
Поэтому электронные облака атома углерода в молекулах СН4, С2Н6 будут максимально удалены друг от друга при sp3-гибридизации, когда их оси направлены к вершинам тетраэдра. При этом в молекуле СН4 все вершины тетраэдра будут заняты атомами водорода, так что молекула СН4 имеет тетраэдрическую конфигурацию с атомом углерода в центре тетраэдра. В молекуле С2Н6 атомы водорода занимают три вершины тетраэдра, а к четвёртой вершине направлено общее электронное облако другого атома углерода, т.е. два атома углерода соединены друг с другом. Это можно представить схемами: -
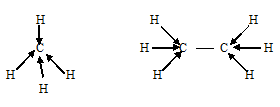
-
б) В молекуле С2Н4 валентный электронный слой атома углерода, как и в молекулах СН4, С2Н6. содержит четыре электронные пары: -
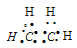
-
При образовании С2Н4 три ковалентные связи образованы по обычному механизму, т.е. являются - связями, и одна - - связь. При образовании молекулы С2Н4 каждый атом углерода с двумя атомами водорода - связями и друг с другом двумя связями, одной - и одной - связями. Гибридные облака, соответствующие данному типу гибридизации, располагаются в атоме углерода так, чтобы взаимодействие между электронами было минимальным, т.е. как можно дальше друг от друга. Данное расположение атомов углерода (две двойные связи между атомами углерода) характерно для sp2-гибридизации АО углерода. При sp2-гибридизации электронные облака в атомах углерода ориентированы в направлениях, лежащих в одной плоскости и составляющих друг с другом углы в 1200, т.е. в направлениях к вершинам правильного треугольника. В молекуле этилена в образовании - связей участвуют три sp2-гибридные орбитали каждого атома углерода, две между двумя атомами водорода и одна со вторым атомом углерода, а - связь образуется за счёт р-электронных облаков каждого атома углерода. Структурная формула молекулы С2Н4 будет иметь вид: -
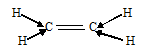
-
в) В молекуле С2Н2 валентный электронный слой атома углерода содержит четыре пары электронов: -
-
Структурная формула С2N2 имеет вид: -
-
Каждый атом углерода соединён одной электронной парой с атомом водорода и тремя электронными парами с другим атомом углерода. Таким образом, в молекуле ацетилена атомы углерода соединены друг с другом одной -связью и двум -связями. С водородом каждый атом углерода соединён -связью. В образовании - связей участвуют две sp-гибридные АО, которые расположены друг относительно друга так, что взаимодействие между ними минимальное, т.е. как можно дальше друг от друга. Поэтому при sp-гибридизации электронные облака между атомами углерода ориентированы в противоположных направлениях друг относительно друга, т.е. угол между связями С—С составляет 1800. Поэтому молекула С2Н2 имеет линейное строение: -

