ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.10.2024
Просмотров: 114
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
4 билетИсточник: https://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/367.html
Гибридизация электронных облаков
Термодинамическая система и ее состояния
Параметры термодинамической системы
Функци состояния термодинамической системы
12. Химическое равновесие. Обратимые и необратимые реакции.
Характеристика растворов. Процесс растворения.
Давление насыщенного пара над раствором. Закон рауля.
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
Лекция по теме «Химические источники тока»
Степень диссоциации возрастает при увеличении температуры раствора. Увеличение кинетической энергии растворенных частиц способствует распаду молекул на ионы, что приводит к возрастанию степени диссоциации при нагревании растворов.
Если в растворе слабой кислоты или слабого основания увеличить концентрацию одноименного иона введением соответствующей соли, то наблюдается резкое изменение степени диссоциации слабого электролита. Рассмотрим, например, как изменится уксусной кислоты (CH3COOH) при введении в раствор ацетата натрия (введение одноименных ионов CH3COO-).
Согласно принципу Ле Шателье равновесие процесса диссоциации
сместится влево в результате увеличения концентрации ацетат-ионов CH3COO-, образующихся при диссоциации ацетата натрия:
CH3COONa CH3COO- + Na+.
Такое смещение равновесия в сторону образования CH3COOH означает уменьшение степени ее диссоциации и приводит к уменьшению концентрации ионов водорода, например:
| C(CH3COOH), моль/л | 0,01 | 0,01 |
| C(CH3COONa), моль/л | | 0,01 |
| [H+], моль/л | 4,32·0-4 | 1,86·10-5 |
Таким образом, в результате введения в 1 л 0,01 М раствора CH3COOH 0,01 моль CH3COONa концентрация ионов водорода уменьшилась в
С точки зрения теории электролитической диссоциации амфотерные гидроксиды (амфолиты) - это вещества, диссоциирующие в водном растворе как по типу кислот, так и по типу оснований. К ним относят Be(OH)2, Zn(OH)2, Pb(OH)2, Sn(OH)2, Al(OH)3, Cr(OH)3, и др. Например, уравнения электролитической диссоциации Be(OH)2:
1) диссоциация по типу основания:
Be(OH)2 + 3H2O OH- + [BeOH(H2O)3]
[BeOH(H2O)3] + H2O OH- + [Be(H2O)4]
2) диссоциация по типу кислоты:
Be(OH)2 + 2H2O H+ + [Be(OH)3H2O]
[Be(OH)2H2O] H+ + [Be(OH)3]
-
Закон разведения Оствальда

Вильгельм Фридрих Оствальд (2.09.1853,—4.04.1932)— балтийский немец, физико-химик и философ-идеалист, лауреат Нобелевской премии по химии 1909 года. Член-корреспондент Петербургской АН (1895).
Между константой и степенью диссоциации существует определенная закономерность, которую в 1888г.обнаружил В.Оствальд и сумел ее объяснить. Эта закономерность впоследствии была названа законом разведения Оствальда.
Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации.
Kдсвязана спростой зависимостью. Если общую молярную концентрацию электролита в растворе обозначить СКА, то для бинарных электролитов концентрации ионов Ky+и Ax-будут равны·CKA. Очевидно, что
[Ky+] = [Ax-] = ·CKA ,
[KA] = CKA - ·CKA = CKA·(1- ), тогда
Для слабых электролитов 0 и (1 - ) 1. Следовательно,
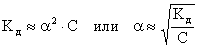 (7.6.7.)
(7.6.7.)Полученная зависимость является математическим выражением закона разбавления Оствальда:
степень диссоциации слабого электролита увеличивается при разбавлении раствора обратно пропорционально корню квадратному из его молярной концентрации.
58 билет
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
А)КИСЛОТЫ
Свойства:
-
способность взаимодействовать с основаниями с образованием солей -
способность взаимодействовать с некоторыми металлами с выделением водорода -
способность изменять цвет индикатора (красная окраска лакмуса) -
кислый вкус
Согласно теории электролитической диссоциации кислоты – это электролиты, диссоциирующие в растворах с образованием ионов (катионов) водорода и анионов кислотного остатка.
Именно ионы водорода вызывают красный цвет лакмуса и сообщают кислотам кислый вкус.
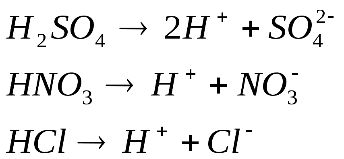
Б)ОСНОВАНИЯ
Свойства:
-
способность взаимодействовать с кислотами с образованием солей -
способность изменять цвет индикатора иначе, чем их изменяют кислоты (синяя окраска лакмуса) -
своеобразный «мыльный вкус»
Согласно теории электролитической диссоциации основания – это электролиты, диссоциирующие в растворах с образованием аниона гидроксила и катиона металла.
Носителем щелочных свойств является анион гидроксила.
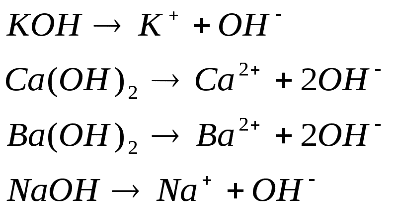
В)СОЛИ
Соли при электролитической диссоциации распадаются на катион металла и анион кислотного остатка. Так как таких ионов, которые были бы общими для водных растворов всех солей нет, поэтому соли и не обладают общими свойствами.
3.Реакции нейтрализации
А) при нейтрализации любой сильной кислоты любым сильным основанием на каждую грамм-молекулу образующейся воды выделяется около 13,8 ккал теплоты.
Это говорит о том, что подобные реакции сводятся к одному процессу. Рассмотрим одну из этих реакций. Перепишем уравнение первой реакции, записывая сильные электролиты в ионной форме, а слабые - в молекулярной, поскольку они находятся в растворе преимущественно в виде молекул.
В ходе реакции ионы Na+ и
Таким образом, реакции нейтрализации любой сильной кислоты любым сильным основанием сводятся к одному и тому же процессу – к образованию молекул воды из ионов водорода и гидроксила.
Реакция образования воды из ионов обратима
Но так как вода слабый электролит и диссоциирует в ничтожно малой степени, то равновесие в этой реакции сильно смещено в сторону образования молекул. Поэтому практически реакция нейтрализации сильной кислоты сильным основанием протекает до конца.
В дальнейшем мы будем широко пользоваться ионно-молекулярной формой записи уравнений реакций с участием электролитов.
При составлении ионно-молекулярных уравнений надо знать, какие соли растворимы в воде и какие практически нерастворимы.
Общие данные о растворимости важнейших солей обычно приведены в таблицах во всех учебниках химии.
Б) нейтрализация слабой кислоты сильным основанием
Здесь сильные электролиты – NaOH и соль, а слабые – кислота и вода:
Так как только ионы натрия не претерпевают изменений, то ионно-молекулярное уравнение имеет вид:
В) нейтрализация сильной кислоты слабым основанием
Здесь в виде ионов мы должны записать кислоту и образующуюся соль, а в виде молекул – гидроксид аммония и воду:
Не изменяются только ионы
Г) нейтрализация слабой кислоты слабым основанием
В этой реакции все вещества, кроме образующейся соли, слабые электролиты. Поэтому ионно-молекулярная форма имеет вид:
ВЫВОД:
Реакции нейтрализации сильных кислот сильными основаниями протекают практически до конца. Реакции нейтрализации, в которых хотя бы одно из исходных веществ – слабый электролит, и при которых молекулы малодиссоциирующих веществ имеются не только в правой, но и в левой части ионно-молекулярного уравнения, протекают не до конца. Они доходят до состояния равновесия, при котором соль существует с кислотой и основанием, из которых она образована. Поэтому уравнения подобных реакций правильнее записывать как обратимые реакции.
FeOHCl2 <--> FeOH(2+) + 2CL(-).
NaHCO3 = Na+ + H+ + CO32-
KMnO4=K(+)+MnO4(-)

