ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.10.2024
Просмотров: 105
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
4 билетИсточник: https://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/367.html
Гибридизация электронных облаков
Термодинамическая система и ее состояния
Параметры термодинамической системы
Функци состояния термодинамической системы
12. Химическое равновесие. Обратимые и необратимые реакции.
Характеристика растворов. Процесс растворения.
Давление насыщенного пара над раствором. Закон рауля.
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
Лекция по теме «Химические источники тока»
 59 билет
59 билет
60 билет
NiSO4 + H2SO4 ⟶ Ni(HSO4)2
Ni2+ + SO42- + 2H+ + SO42- ⟶ Ni2+ + 2HSO4- SO42- + H+ ⟶ HSO4-
Na2S + H2SO4 ⟶ Na2SO4 + H2S↑
2Na+ + S2- + 2H+ + SO42- ⟶ 2Na+ + SO42- + H2S↑
2H+ + S2- ⟶ H2S↑
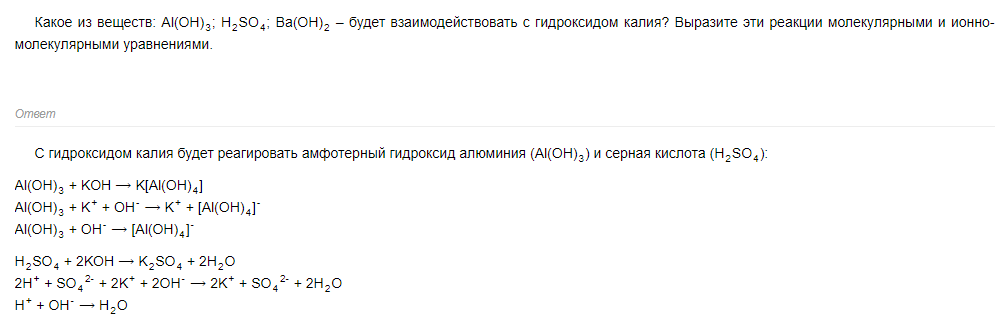
Молекулярное: 2Al(OH)3 + 3H2SO4 -> Al2(SO4)3 + 6H2O
Полное ионное: 2Al(OH)3 + 6H(+)+3SO4(-2) -> 2Al(+3)+3SO4(-2) + 6H2O
Сокращенное ионное: Al(OH)3 + 3H(+) -> Al(+3) + 3H2O
61 билет
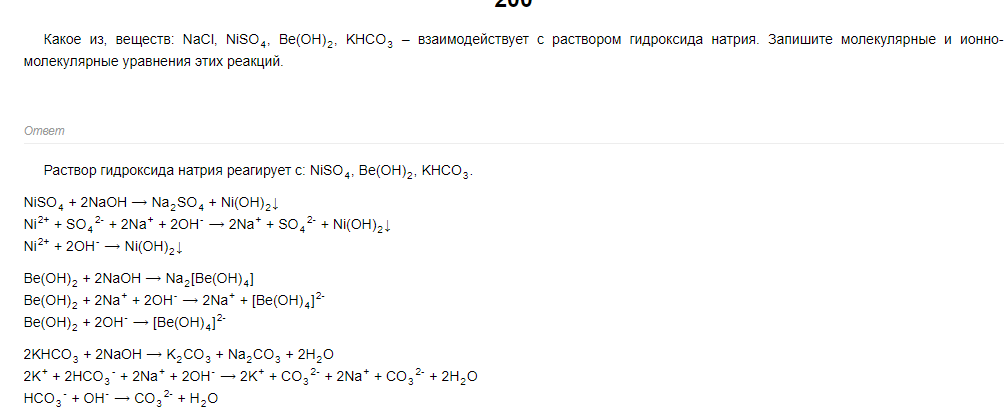 62 билет
62 билет
Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом,кальция и магния (так называемых «солей жёсткости»).
Различают следующие виды жесткости.
Общая жесткость. Определяется суммарной концентрацией ионов кальция и магния. Представляет собой сумму карбонатной (временной) и некарбонатной (постоянной) жесткости.
Карбонатная жесткость. Обусловлена наличием в воде гидрокарбонатов и карбонатов (при рН>8.3) кальция и магния. Данный тип жесткости почти полностью устраняется при кипячении воды и поэтому называется временной жесткостью. При нагреве воды гидрокарбонаты распадаются с образованием угольной кислоты и выпадением в осадок карбоната кальция и гидроксида магния.
Некарбонатная жесткость. Обусловлена присутствием кальциевых и магниевых солей сильных кислот (серной, азотной, соляной) и при кипячении не устраняется (постоянная жесткость).
Итак, как уменьшить жесткость воды кипячением?
Считается, что кипячение (термоумягчение) – один из основных методов борьбы с жесткостью. На самом деле, с помощью повышенных температур можно избавиться только от временной жесткости.
Ca(HCO3)2 → CaCO3↓ + CO2 + H2O.
При этом сульфаты и хлориды кальция и магния так и остаются в растворе.
Реагентные способы устранения жесткости воды
Метод реагентного умягчения основан на добавлении в воду гашеной извести или кальцинированной соды. При этом активные компоненты переводят соли магния и кальция в нерастворимые соединения, которые и выпадают в осадок.
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
На сегодняшний день самым эффективным реагентом является ортофосфат натрия, который входит в состав многих умягчителей.
3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaHCO3
3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4
Реагентные методы можно считать наиболее эффективными среди существующих способов устранения жесткости. Однако данные методики оправдывают себя только при относительно большом расходе воды, поскольку необходимо точно рассчитывать дозировку реагента и регулярно утилизировать отфильтрованный осадок.
Реагентное устранение жесткости воды – одно из основных направлений развития и изучения ионообменной технологии умягчения. Подробнее про ионообменные фильтры. Специальные загрузки заменяют ионы кальция и магния на ионы натрия и водорода. Таким образом, можно понизить жесткость до 0,05 °Ж. Мы уже писали о допустимых нормах жесткости воды.
Безреагентные способы устранения жесткости воды
Мембранные, термические и электрические методы устранения жесткости воды не предполагают использование химических реактивов. В процессе ультра- и нанофильтрации, а также обратного осмоса полупроницаемые мембраны задерживают ионы магния и кальция. К недостаткам метода следует отнести необходимость регулярной промывки или замены мембраны.
Устранение жесткости воды с помощью электродиализа основано на удалении солей кальция и магния под действием электрического поля. Данный метод, как и технология работы магнитных преобразователей, находится еще на этапе подробного изучения. Подробнее про принцип работы магнитного умягчителя.
Дистилляцию тоже можно отнести к безреагентным способам устранения жесткости. Однако выпаривание - скорее универсальный
, чем специальный метод обессоливания водопроводной воды.
63 билет
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ, разность электростатич. потенциалов между электродом и находящимся с ним в контакте электролитом. Возникновение электродного потенциала обусловлено пространств. разделением зарядов противоположного знака на границе раздела фаз и образованием двойного электрического слоя. На границе между металлич. электродом и р-ром электролита пространств. разделение зарядов связано со след. явлениями: переносом ионов из металла в р-р в ходе установления электрохим. равновесия, кулоновской адсорбцией ионов из р-ра на пов-сть металла, смещением электронного газа за пределы положительно заряженного ионного остова кристаллич. решетки, специфич. (некулоновской) адсорбцией ионов или полярных молекул р-рителя на электроде и др. Последние два явления приводят к тому, что электродный потенциал не равен нулю даже при условиях, когда заряд пов-сти металла равен нулю (см. Потенциал нулевого заряда).
Абс. величину электродного потенциала отдельного электрода определить невозможно, поэтому измеряют всегда разность потенциалов исследуемого электрода и нек-рого стандартного электрода сравнения. Электродный потенциал равен эдс электрохим. цепи, составленной из исследуемого и стандартного электродов (диффузионный потенциал между разными электролитами, обусловленный различием скоростей движения ионов, при этом должен быть устранен). Для водных р-ров в качестве стандартного электрода обычно используют водородный электрод (Pt, Н2[0,101 МПа] | Н+[a= 1]), потенциал к-рого при давлении водорода 0,101 МПа и термодинамич. активности а ионов Н+ в р-ре, равной 1, принимают условно равным нулю (водородная шкала электродных потенциалов). При схематич. изображении цепи водородный электрод всегда записывают слева; напр., потенциал медного электрода в р-ре соли меди равен эдс цепи Pt, H2|HCl
Если исследуемый электрод находится в стандартных условиях, когда активности всех ионов, определяющих электродный потенциал, равны 1, а давление газа (для газовых электродов) равно 0,101 МПа, значение электродного потенциала наз. стандартным (обозначение E°).
Оно связано со стандартным изменением энергии Гиббса
Зависимость электродного потенциала от термодинамич. активностей ai участников электрохим. р-ции выражается Нернста уравнением:
где vi - стехиометрич. коэф. участника р-ции, причем для исходных в-в это отрицат. величина, а для продуктов р-ции -положительная.
Если через электрод протекает электрич. ток, электродный потенциал отклоняется от равновесного значения из-за конечной скорости процессов, происходящих непосредственно на границе электрод - электролит.
Водородный электрод, платиновая пластинка, электролитически покрытая платиновой чернью, погружённая в раствор кислоты с определённой концентрацией ионов водорода Н+ и омываемая током газообразного водорода. Потенциал водородного электрода возникает за счёт обратимо протекающей реакции
Между водородом, адсорбированным платиновой чернью, и ионами водорода в растворе устанавливается равновесие. Потенциал электрода Е определяется уравнением Нернста:
где Т — абсолютная температура (К), аН+ — активная концентрация ионов водорода (г-ион/л), р — давление водорода [кгс/см2 (атм)], Е° — нормальный (или стандартный) потенциал водородного электрода при р = 1 кгс/см2 (1 атм) и aH+ = 1. При любой заданной температуре Е° условно принято считать равным нулю. От потенциала стандартного водородного электрода отсчитывают потенциалы всех других электродов (так называемая водородная шкала потенциалов). При работе с водородным электродом необходима тщательная очистка водорода от примесей. Особенно опасны соединения серы и мышьяка, а также кислород, реагирующий с водородом на поверхности платины с образованием воды, что приводит к нарушению равновесия

