ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.10.2024
Просмотров: 97
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
4 билетИсточник: https://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/367.html
Гибридизация электронных облаков
Термодинамическая система и ее состояния
Параметры термодинамической системы
Функци состояния термодинамической системы
12. Химическое равновесие. Обратимые и необратимые реакции.
Характеристика растворов. Процесс растворения.
Давление насыщенного пара над раствором. Закон рауля.
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
Лекция по теме «Химические источники тока»
, количественно характеризуется степенью электролитической диссоциации и обозначается через a.
(1) Степень электролитической диссоциации равна отношению числа молекул п, распавшихся на ионы, к общему числу растворенных молекул N.
Величина степени электролитической диссоциации зависит от природы растворенного вещества и растворителя, а также от концентрации и температуры раствора.
(2) Если вещество не диссоциирует при растворении (п = 0, a= 0), оно не будет электролитом. Если а близка к единице, то п= N,и соединение является сильным электролитом. Для многих химических соединений 0 < a < 1, следовательно, п < N,т. е. они будут слабыми электролитами.
(3) По способности к диссоциации Аррениус разделил все электролиты на три группы: сильные электролиты (a> 30%), электролиты средней силы (a= 5 — 30%), слабые электролиты (a< 5%). К сильным электролитам были отнесены: соляная, бромисто-водородная, йодисто-водородная, азотная, серная, марганцовая кислоты; щелочи, гидроокись бария, а также большинство солей. Согласно теории Аррениуса для сильных электролитов характерна значительная диссоциация и, следовательно, хорошая электропроводность.
К слабым электролитам относятся почти все органические кислоты (муравьиная, уксусная, бензойная), цианистоводородная кислота, борная кислота, угольная кислота, сероводородная кислота, гидроокись аммония, вода, а также некоторые соли (НgС12 и т.п.). Для растворов слабых электролитов характерна очень небольшая величина электро-проводности.
К электролитам средней силы относятся фосфорная, мышьяковая, йодная, хромовая, сернистая кислоты и целый ряд других соединений,
СЛ. 4 3. Силы взаимодействия между ионами отсутствуют, и растворы электролитов ведут себя подобно идеальным газовым системам. Это положение автором теории электролитической диссоциации и его последователями прямо не высказывалось, но оно лежит в основе всех ее количественных соотношений.
При помощи трех постулатов теория электролитической диссоциации смогла объяснить многие свойства раствора, дать их количественную характеристику и истолковать многочисленные факты и закономерности.
В своих работах Аррениус показал, что степень диссоциации электролита а можно связать с коэффициентом Вант-Гоффа
i.СЛ. 5 (0) Предположим, что в растворе находилось Nмолекул электролита, из которых только ппродиссоциировало на ионы. Число непродиссоциированных молекул N - п,а число образовавшихся ионов n п , где n — количество ионов, на которое диссоциирует одна молекула электролита. Тогда число всех частиц в растворе, включая и молекулы, и ионы, будет равно (N—п)+n п, или после соответствующего преобразования: N+n(n-1), подставим в уравнение(*):
(1) 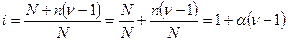
(2) откуда
Из всего вышеизложенного можно сделать следующие выводы.
1. Растворы электролитов будут изотоничными, если при одинаковой температуре они содержат одинаковое число частиц (молекулы + ионы) в единице объема.
2. Из двух растворов с одинаковой молярной концентрацией осмотическое давление будет выше в растворе электролита с более высокой степенью диссоциации a.
3. Из двух растворов с одинаковой молярной концентрацией и степенью диссоциации a осмотическое давление будет выше в растворе электролита, диссоциирующего на большее число ионов.
Степень диссоциация прямо зависит от полярности связи между двумя атомами. А полярность, в свою очередь, определяется разностью электроотрицательностей этих атомов - чем она больше, тем более полярная связь и тем легче происходит диссоциация.

MgCl2 -> Mg(2+) + 2Cl(-) n=3 (число ионов)
Возьмем 1 л (1000 мл) раствора MgCl2, тогда
mр-ра(MgCl2) = V*p = 1000*1=1000 г
m(MgCl2)=mр-ра*w/100 = 1000*0,5/100 = 5 См(MgCl2) = m/M*V = 5/95*1 =0,053 моль/л = 53 моль/м3
Изотонический коэффициент равен:
i = Pосм/См*R*T =3,2*10^ (5) / 53*8,314*291 =2,5
α = i - 1 / n -1 = 2,5-1 / 3 - 1 = 1,5/2 = 0,75
https://vk.com/wall-27835604_3459
по 2 закону Рауля можно рассчитать
dT=К*м
м=20/1,86=10,75 моль/кг
молярня масса этиленгликоля Mr=62г/моль
n=m/Mr => m=10,75*62=666,7 г
при 20°С уд. вес этиленгликоля 1,1138
V=666,7/1,1138=599мл (примерно 600мл) , а воды 1000 мл, т. к. уд. вес воды=1
Вот и получается э/г : Н2О=600 : 1000 = 3 :5
^t = Cm*K . Cm = 25 / 1.86 = 13.44 моль/кг - моляльная концентрация этиленгликоля .
V э-г = 13.44*62 / 1.116 = 747 см3
Объёмные отношения этиленгликоля и воды 0,747 /1 или 3 : 4
*0,53
ΔT зам=K*Cm
n=m/M=18,4/92=0,2 моль
Сm=0,2/0,2=1 моль/кг
ΔT=1,86*1=1,86
t зам=0-1,86=-1,86*С
ΔTкип=Е*Cm=0,52*1=0,52
tкип=100+0,52=100,52*С
Кроме константы диссоциации силу электролита можно определить по значению другого параметра, зависящего от концентрации раствора. Таким параметром является кажущаяся степень диссоциации которая показывает долю молекул распавшихся на ионы.
Степень диссоциации ( ) - это отношение числа распавшихся на ионы молекул (Nдис.) к общему числу молекул растворенного вещества (Nобщ.):
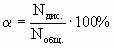 (7.6.4.)
(7.6.4.)
Степень диссоциации выражают в долях единицы или в процентах. Поскольку общее число молекул вещества в растворе пропорционально количеству его вещества и его молярной концентрации, то можно записать:
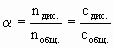 (7.6.5.)
(7.6.5.)
где nдис. и cдис. - соответственно, количество и молярная концентрация растворенного вещества, подвергшегося электролитической диссоциации.
К сильным электролитам условно относят вещества, кажущаяся степень диссоциации которых в растворе превышает 30% ( > 0,3). При < 3% ( < 0,03) электролиты считают слабыми, в других случаях о них говорят как об электролитах средней силы.
Степень диссоциации обычно определяют по данным измерения электропроводности растворов, которая прямо пропорциональна концентрации свободно движущихся ионов. При этом получают не истинные значения , а кажущиеся значения. Они всегда меньше истинных значений , т.к. ионы при движении к электродам сталкиваются и частично уменьшают свою подвижность, особенно при высокой их концентрации в растворе, когда возникает электростатическое притяжение между ионами. Например, истинное значение степени электролитической диссоциации HCl в разбавленном растворе равно 1, в 1 М растворе = 0,78 (78%) при 180 С, однако, в этом растворе не содержится 22% недиссоциированных молекул HCl, практически все молекулы диссоциированы.
Электролиты, которые в разбавленном водном растворе диссоциируют практически полностью, называют сильными электролитами.
К сильным электролитам в водных растворах принадлежат почти все соли, многие неорганические кислоты (H2SO4, HNO3, HClO4, галогеноводородные, кроме HF и др.), гидроксиды s-элементов (исключение - Be(OH)2 и Mg(OH)2). Кажущиеся значения a этих электролитов находятся в пределах от 70 до 100%. Диссоциация сильных электролитов - это практически необратимый процесс:
HCl H+ + Cl- или HCl = H+ + Cl-
С точки зрения теории электролитической диссоциации кислоты - это вещества, диссоциирующие в водном растворе с образованием катионов водорода и анионов кислотного остатка, основания - это вещества, диссоциирующие в водном растворе с образованием гидроксид-ионов OH
- и катионов металла.
Слабые многоосновные кислоты диссоциируют ступенчато. Каждую ступень характеризуют своим значением константы диссоциации, например:
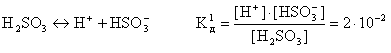
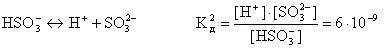
В связи со ступенчатой диссоциацией многоосновные кислоты способны образовывать кислые соли, NaHSO4, NaHCO3, K2HPO4 и т.д.
Слабые многокислотные основания диссоциируют ступенчато:
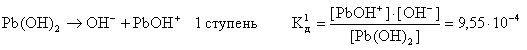

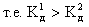
Этим объясняют способность многокислотных оснований образовывать основные соли: CuOHCl, (ZnOH)2SO4 и др.
Электролиты, которые в разбавленном водном растворе диссоциируют частично, называют слабыми. Диссоциация слабых электролитов - обратимый процесс
например:
Степень электролитической диссоциации зависит от:
и возрастает при увеличении разбавления раствора:
Величина степени электролитической диссоциации зависит от природы растворенного вещества и растворителя, а также от концентрации и температуры раствора.
К слабым электролитам относятся почти все органические кислоты (муравьиная, уксусная, бензойная), цианистоводородная кислота, борная кислота, угольная кислота, сероводородная кислота, гидроокись аммония, вода, а также некоторые соли (НgС12 и т.п.). Для растворов слабых электролитов характерна очень небольшая величина электро-проводности.
К электролитам средней силы относятся фосфорная, мышьяковая, йодная, хромовая, сернистая кислоты и целый ряд других соединений,
При помощи трех постулатов теория электролитической диссоциации смогла объяснить многие свойства раствора, дать их количественную характеристику и истолковать многочисленные факты и закономерности.
В своих работах Аррениус показал, что степень диссоциации электролита а можно связать с коэффициентом Вант-Гоффа
i.
Из всего вышеизложенного можно сделать следующие выводы.
1. Растворы электролитов будут изотоничными, если при одинаковой температуре они содержат одинаковое число частиц (молекулы + ионы) в единице объема.
2. Из двух растворов с одинаковой молярной концентрацией осмотическое давление будет выше в растворе электролита с более высокой степенью диссоциации a.
3. Из двух растворов с одинаковой молярной концентрацией и степенью диссоциации a осмотическое давление будет выше в растворе электролита, диссоциирующего на большее число ионов.
Степень диссоциация прямо зависит от полярности связи между двумя атомами. А полярность, в свою очередь, определяется разностью электроотрицательностей этих атомов - чем она больше, тем более полярная связь и тем легче происходит диссоциация.
50 билет

51 билет
MgCl2 -> Mg(2+) + 2Cl(-) n=3 (число ионов)
Возьмем 1 л (1000 мл) раствора MgCl2, тогда
mр-ра(MgCl2) = V*p = 1000*1=1000 г
m(MgCl2)=mр-ра*w/100 = 1000*0,5/100 = 5 См(MgCl2) = m/M*V = 5/95*1 =0,053 моль/л = 53 моль/м3
Изотонический коэффициент равен:
i = Pосм/См*R*T =3,2*10^ (5) / 53*8,314*291 =2,5
α = i - 1 / n -1 = 2,5-1 / 3 - 1 = 1,5/2 = 0,75
https://vk.com/wall-27835604_3459
52 билет
по 2 закону Рауля можно рассчитать
dT=К*м
м=20/1,86=10,75 моль/кг
молярня масса этиленгликоля Mr=62г/моль
n=m/Mr => m=10,75*62=666,7 г
при 20°С уд. вес этиленгликоля 1,1138
V=666,7/1,1138=599мл (примерно 600мл) , а воды 1000 мл, т. к. уд. вес воды=1
Вот и получается э/г : Н2О=600 : 1000 = 3 :5
53 билет
^t = Cm*K . Cm = 25 / 1.86 = 13.44 моль/кг - моляльная концентрация этиленгликоля .
V э-г = 13.44*62 / 1.116 = 747 см3
Объёмные отношения этиленгликоля и воды 0,747 /1 или 3 : 4
 54 билет
54 билет
 55 билет
55 билет
*0,53
56 билет
ΔT зам=K*Cm
n=m/M=18,4/92=0,2 моль
Сm=0,2/0,2=1 моль/кг
ΔT=1,86*1=1,86
t зам=0-1,86=-1,86*С
ΔTкип=Е*Cm=0,52*1=0,52
tкип=100+0,52=100,52*С
57 билет
-
Степень диссоциации. Сильные и слабые электролиты
Кроме константы диссоциации силу электролита можно определить по значению другого параметра, зависящего от концентрации раствора. Таким параметром является кажущаяся степень диссоциации которая показывает долю молекул распавшихся на ионы.
Степень диссоциации ( ) - это отношение числа распавшихся на ионы молекул (Nдис.) к общему числу молекул растворенного вещества (Nобщ.):
Степень диссоциации выражают в долях единицы или в процентах. Поскольку общее число молекул вещества в растворе пропорционально количеству его вещества и его молярной концентрации, то можно записать:
где nдис. и cдис. - соответственно, количество и молярная концентрация растворенного вещества, подвергшегося электролитической диссоциации.
К сильным электролитам условно относят вещества, кажущаяся степень диссоциации которых в растворе превышает 30% ( > 0,3). При < 3% ( < 0,03) электролиты считают слабыми, в других случаях о них говорят как об электролитах средней силы.
Степень диссоциации обычно определяют по данным измерения электропроводности растворов, которая прямо пропорциональна концентрации свободно движущихся ионов. При этом получают не истинные значения , а кажущиеся значения. Они всегда меньше истинных значений , т.к. ионы при движении к электродам сталкиваются и частично уменьшают свою подвижность, особенно при высокой их концентрации в растворе, когда возникает электростатическое притяжение между ионами. Например, истинное значение степени электролитической диссоциации HCl в разбавленном растворе равно 1, в 1 М растворе = 0,78 (78%) при 180 С, однако, в этом растворе не содержится 22% недиссоциированных молекул HCl, практически все молекулы диссоциированы.
Электролиты, которые в разбавленном водном растворе диссоциируют практически полностью, называют сильными электролитами.
К сильным электролитам в водных растворах принадлежат почти все соли, многие неорганические кислоты (H2SO4, HNO3, HClO4, галогеноводородные, кроме HF и др.), гидроксиды s-элементов (исключение - Be(OH)2 и Mg(OH)2). Кажущиеся значения a этих электролитов находятся в пределах от 70 до 100%. Диссоциация сильных электролитов - это практически необратимый процесс:
HCl H+ + Cl- или HCl = H+ + Cl-
С точки зрения теории электролитической диссоциации кислоты - это вещества, диссоциирующие в водном растворе с образованием катионов водорода и анионов кислотного остатка, основания - это вещества, диссоциирующие в водном растворе с образованием гидроксид-ионов OH
- и катионов металла.
Слабые многоосновные кислоты диссоциируют ступенчато. Каждую ступень характеризуют своим значением константы диссоциации, например:
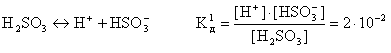
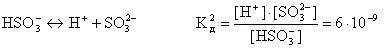
В связи со ступенчатой диссоциацией многоосновные кислоты способны образовывать кислые соли, NaHSO4, NaHCO3, K2HPO4 и т.д.
Слабые многокислотные основания диссоциируют ступенчато:
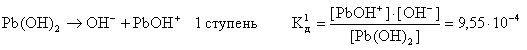

Этим объясняют способность многокислотных оснований образовывать основные соли: CuOHCl, (ZnOH)2SO4 и др.
Электролиты, которые в разбавленном водном растворе диссоциируют частично, называют слабыми. Диссоциация слабых электролитов - обратимый процесс
например:
| | (при 25 С) |
| HCN H+ + CN- | 7·10-5 (или 0,007%) |
| | 0,013 (или 1,3%) |
Степень электролитической диссоциации зависит от:
-
природы электролита и растворителя; -
концентрации раствора; -
температуры
и возрастает при увеличении разбавления раствора:
| C(CH3COOH) , моль/л | 0,2 | 0,1 | 0,05 | 0,01 | 0,005 | 0,001 | |
| , % (при 25° С) | 0,05 | 1,4 | 1,9 | 4,2 | 6,0 | 12,4 | |
| | слабый электролит | электролит средней силы | |||||

