ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.10.2024
Просмотров: 135
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
4 билетИсточник: https://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/367.html
Гибридизация электронных облаков
Термодинамическая система и ее состояния
Параметры термодинамической системы
Функци состояния термодинамической системы
12. Химическое равновесие. Обратимые и необратимые реакции.
Характеристика растворов. Процесс растворения.
Давление насыщенного пара над раствором. Закон рауля.
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
Лекция по теме «Химические источники тока»
Законы электролиза
Количественная характеристика процессов электролиза определяется законами Фарадея.
Первый закон Фарадея
Масса вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду, прошедшему через электролит.
Второй закон Фарадея
При постоянном количестве прошедшего электричества массы образующихся на электродах веществ пропорциональны их эквивалентным массам:
Для выделения 1 эквивалента вещества нужно пропустить через электролизер 1 Фарадей количества электричества:
1F=96500 Кл/моль=26,8г/А*ч
В обобщенном виде законы Фарадея записывают:
где m - масса в-ва образуемого на электроде (в г); Мэ – эквивалентная масса; i – сила тока (в А);
τ – время электролиза; q – количество электричества
Электрохимический эквивалент КЭ – число, показывающее какая масса вещества выделится на электродах при прохождении 1 Кл электричества
Выход по току
Показателем эффективности электролиза является выход по току – отношение массы фактически полученного при электролизе полезного продукта к его массе отвечающей законам Фарадея:
7.Комплексные соединения. Состав и строение комплексных соединений: комплексообразователь, лиганды, комплексный ион, координационное число, внутренняя и внешняя сфера. Номенклатура комплексных соединений.
При взаимодействии молекул часто образуются более сложные соединения, соединения высшего порядка.
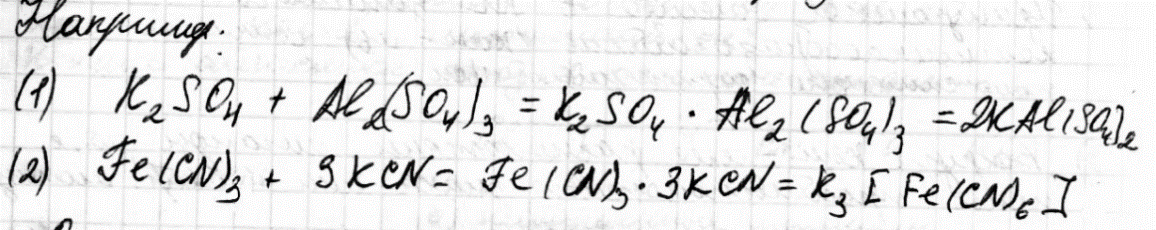
Одни из них диссоциируют на все составляющие ионы, и называются двойными солями (1), другие на сложные (комплексные ионы), и называются комплексными или координационными соединениями (2).
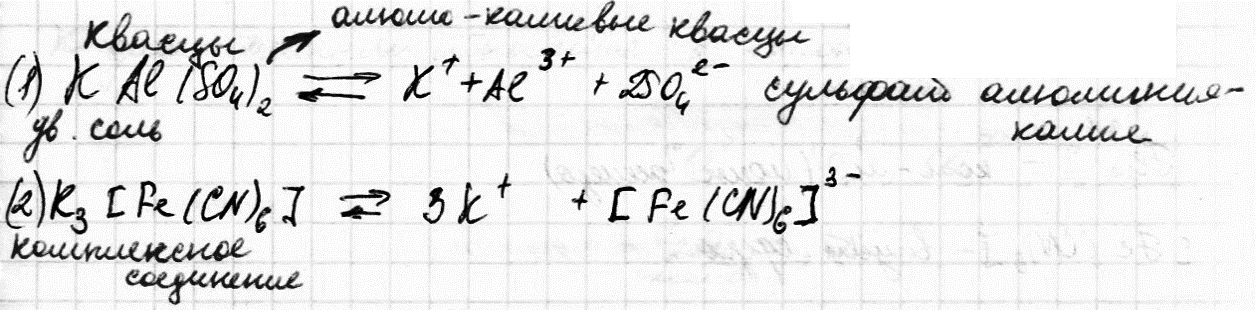
К комплексным соединениям относятся такие вещества, которые содержат группу, способных к независимому существованию атомов или молекул (лигандов), координированных в определенном порядке, вокруг центрального атома, называемого комплексообразователем.
69 билет
Стандартный потенциал никеля (-0,250в) , поэтому при электролизе на катоде в основном происходит разряд ионов Ni(+2) и выделение металла, на угольном аноде - выделение кислорода, на никелевом аноде - окисление металла - растворение анода. Процесс применяется для очистки никеля ( электролитическое рафинирование) + никелирование .
70 билет
Соль образована катионом сильного основания и анионом сильной кислоты. При электролизе на всегда окисляется вода, а на катоде- восстанавливается вода.
K: 2H2O + 2e --> H2 + 2OH(-)
A: 2H2O -4e --> O2 + 4H(+)
2H2O --> 2H2 + O2 m(H2) = 0,02 г
m(O2) = 32*1930/(96500*4) = 0,16 г.
71 билет
Упрощенный расчет выглядит так:
1) рассчитываете Е 298 для возможных процессов на катоде: Ni2+ +2e- = Ni с учетом [Ni2+] и 2H+ +2e- = H2 (а точнее для процесса 2H2O +2e- = H2 + 2OH-) без учета гидролиза по катиону Ni2+ (т.е. для [H+] = 10^-7 моль/л);
2) рассчитываете Е 298 для процесса на аноде 2H2O -4e- = O2 + 4H+ опять же без учета гидролиза по катиону Ni2+;
3) вычисляете напряжение разложения электролита NiSO4 как разность E 298 анодного процесса — E 298 катодного процесса для определения наиболее вероятного процесса на катоде (процесс на катоде с меньшей разностью будет преобладать);
4) по ф-ам m = M*I*t/(z*F) и V = Vm*I*t/(z*F) рассчитываете массу и объем продуктов элек-а;
для более точного расчета придется вычислить [H+] с учетом гидролиза NiSO4 по катиону Ni2+ (потребуются справ. данные по Кд. Ni(OH)2 по 2 ступени), пересчитать Е 298 для процессов 2H+ +2e- = H2 и 2H2O -4e- = O2 + 4H+, а далее — см. п. 3) и 4) выше.
72 билет
Непонятно, зачем указано время электролиза — кол-во элек-ва (Кл) и есть произведение силы тока на время в сек.;
при эл-зе расплава AlCl3 на катоде выд-ся Al массой 27*1965/(3*96485) = 0.1833 г, на аноде — Cl2 V = 22.4*1965/(2*96485) = 0.228 л;
при эл-зе раствора AlCl3 на катоде выд-ся H2, а на аноде — Cl2 одинаковым V = 22.4*1965/(2*96485) = 0.228 л.
73 билет
74 билет

75 билет

76 билет
Лекция по теме «Химические источники тока»
Учебные вопросы
-
Виды химических источников тока -
Классификация гальванических элементов -
Принцип действия аккумулятора -
Топливные элементы
-
Виды химических источников тока
Химическими источниками тока (ХИТ) называются электрохимические устройства, в результате работы которых химическая энергия окислительно-восстановительных процессов превращается в электрическую энергию постоянного тока. К ним относятся гальванические элементы, аккумуляторы, топливные элементы. Во всех видах химических источниках тока используются электролиты – водные, неводные, твердые. К достоинствам современных ХИТ относятся относительно высокие КПД (до 0,8) и высокая удельная мощность (количество энергии, отдаваемое в единицу времени единицей массы ХИТ), что позволяет им конкурировать с другими источниками тока. Основным их недостатком является ограниченный срок службы.
-
Классификация гальванических элементов
Среди большого разнообразия гальванических элементов можно выделить три основных типа.
Первый тип .Пластины из двух различных металлов находятся в растворах солей
, содержащих собственные ионы. К этому типу относится медно-цинковый гальванический элемент (элемент Даниэля – Якоби ).
Второй тип. Пластины из двух различных металлов находятся в растворе одного электролита. Примером может служить элемент Вольта, состоящий из двух пластин (Zn и Cu), погруженных в раствор серной кислоты. При его работе происходят следующие процессы:
(-) А: Zn Zn2+ + 2 - окисление (анодный процесс)
(+) К: 2Н+ + 2 Н2 - восстановление (катодный процесс)
Выделяющийся водород насыщает поверхность катода (меди), в результате чего получается электрод другого состава (не медный, а водородный).
Схема гальванического элемента Вольта:
2
( -) Zn / Zn2+ H2SO4 2H+ / H2 (Cu) (+)
В скобках справа указывается (Сu) - место выделения водорода.
Третий тип. Гальванические элементы составлены из двух совершенно одинаковых по природе электродов (например, медных), погруженных в растворы одного и того же электролита, но различной концентрации. Такие элементы называются концентрационными.
Схема медного концентрационного гальванического элемента:
2
( -) Cu / CuSO4 CuSO4 / Cu (+) ,
C1 < С2
где C1 и С2 - концентрация раствора электролита, моль/л.
Роль анода выполняет электрод, находящийся в более разбавленном растворе, так как его электродный потенциал имеет более низкое значение по сравнению со вторым электродом. ЭДС такого гальванического элемента зависит только от соотношения концентраций потенциалопределяющих ионов (в данном случае от концентрации CuSO4).
Практического значения как источники электрической энергии концентрационные гальванические элементы не имеют.
-
Принцип действия аккумулятора
Аккумуляторы – гальванические элементы, которые на основе обратимых электрохимических реакций могут многократно накапливать химическую энергию и отдавать ее для потребления в виде электрической энергии постоянного тока.
Аккумуляторы - устройства многоразового действия, сочетающие в себе гальванический элемент и электролизер. Под воздействием внешнего постоянного тока в них аккумулируется (накапливается) химическая энергия, которая затем превращается в электрическую в результате окислительно-восстановительной реакции. Процесс накопления химической энергии называют
зарядом аккумулятора, процесс ее превращения в электрическую - разрядом аккумулятора. В первом случае аккумулятор работает как электролизер, во втором – как гальванический элемент.
Устройство и принцип действия всех аккумуляторов одинаков. Основное отличие состоит в материале электродов и типе электролита. На аноде как при разряде, так и при заряде протекает процесс окисления, на катоде – процесс восстановления.
Наиболее распространенными являются кислотные и щелочные аккумуляторы.
Кислотный аккумулятор (свинцовый аккумулятор) представляет собой пластины в виде отливок из хартблея (твердого свинца с примесью сурьмы) ячеистой структуры, собранные в батареи и помещенные в баки из эбонита или полипропилена с электролитом. В ячейки пластин предварительно запрессовывается смесь оксида свинца (PbO) с глицерином, обладающая способностью затвердевать в виде глицерата свинца. Электролитом служит раствор серной кислоты (35 - 40 % раствор H2SO4). При взаимодействии оксида свинца с H2SO4 образуется PbSO4.
PbOтв. + H2SO4(р-р) PbSO4тв. + H2O
При первичной и последующих зарядах аккумулятора, когда он работает как электрохимическая ячейка, PbSO4 на катоде превращается в свинец (Pb), а аноде - в диоксид свинца (PbO2), которые и являются электродами:
(-) К : PbSO4(тв) + 2 Pb(тв) + SO (р-р)
(+) А : PbSO4(тв) +2 Н2О PbО2(тв) + 2 + 4 Н+ + SO (р-р)
2 PbSO4(тв) + 2H2O Pb(тв) + PbO2(тв) + 2 H2SO4(р-р)
ЭДС заряженного аккумулятора приблизительно равна 2 В (если 6 таких аккумуляторов последовательно соединить, получается обычный автомобильный аккумулятор с ЭДС = 12В).
При работе аккумулятора – его разрядке, когда он работает как химический источник тока, на электродах протекают электродные процессы в обратном направлении.
По мере его разрядки расходуются материалы катода (PbО2) , анода (Pb) и электролит - серная кислота. Напряжение на зажимах аккумулятора падает и его необходимо заряжать. Для зарядки аккумулятор подключают к внешнему источнику тока, направление тока противоположно разрядному.
Токообразующие и электродные реакции в свинцовом аккумуляторе можно представить в виде:
Pb(тв) + SO (р-р) PbSO4(тв

