ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.10.2024
Просмотров: 124
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
4 билетИсточник: https://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/367.html
Гибридизация электронных облаков
Термодинамическая система и ее состояния
Параметры термодинамической системы
Функци состояния термодинамической системы
12. Химическое равновесие. Обратимые и необратимые реакции.
Характеристика растворов. Процесс растворения.
Давление насыщенного пара над раствором. Закон рауля.
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
Лекция по теме «Химические источники тока»
, Константа скорости: 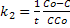 , время полупревращения t=
, время полупревращения t=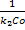 .
.
2) В реакции участвуют два реагента, начальные концентрации которых не равны: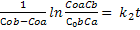 , На протяжении всей реакции выполняется:
, На протяжении всей реакции выполняется: 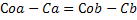 , время полупревращения t=
, время полупревращения t=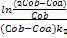 .
.
Методы определения порядка реакции:
1)Метод подстановки основан на подстановке экспериментальных данных
2)Метод Вант-Гоффа: n=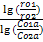
3)По периоду полупревращения (не применимо для реакций первого порядка): n=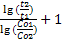
4)Графический метод: lnC от t (прямая линия): tga=n
16. Влияние температуры на скорость химической реакции. Правило Вант-Гоффа. Понятие о теории активных соударений. Уравнение Аррениуса. Энергия активации. Понятие об активированном комплексе. Аналитический и графический методы определения энергии активации.
Вант-Гофф установил, что при повышении температуры на 10К скорость реакции увеличивается в 2-4 раза. Коэффициент =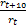 =
=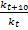 был назван температурным коэффициентом Вант-Гоффа.Правило Вант-Гоффа имеет вид: rt2=rt1
был назван температурным коэффициентом Вант-Гоффа.Правило Вант-Гоффа имеет вид: rt2=rt1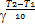 . Более точную зависимость константы скорости от температуры устанавливает уравнение Аррениуса: k=koexp(-
. Более точную зависимость константы скорости от температуры устанавливает уравнение Аррениуса: k=koexp(-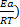 , где Еа-аррениусовская или опытная энергия активации, ko- множитель, зависящий от природы веществ. Энергию активации можно вычислить по значениям константы скорости, измеренным при нескольких температурах: построить график lnk от 1/T, тангенс угла наклона полученной прямой линии
, где Еа-аррениусовская или опытная энергия активации, ko- множитель, зависящий от природы веществ. Энергию активации можно вычислить по значениям константы скорости, измеренным при нескольких температурах: построить график lnk от 1/T, тангенс угла наклона полученной прямой линии
равен (-Еа/R). Также можно найти энергию активации, если известны константы скорости при двух температурах:
Еа=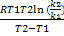 . Теория активных столкновений базируется на двух положениях: реакция существляется в момент столкновения двух молекул, столкновение молекул приводит к химическому превращению только в том случае, когда молекулы обладают достаточно большим запасом энергии, больше так называемой истинной энергии активации Ео. Ео=Еа - ½RT.
. Теория активных столкновений базируется на двух положениях: реакция существляется в момент столкновения двух молекул, столкновение молекул приводит к химическому превращению только в том случае, когда молекулы обладают достаточно большим запасом энергии, больше так называемой истинной энергии активации Ео. Ео=Еа - ½RT.
В теории активированного комплекса для любой элементарной реакции предполагается. что начальная конфигурация атомов переходит в конечную в результате непрерывного изменения межъядерных расстояний.
Активированным комплексом называется промежуточная конфигурация системы А..В..С, в которой связь В-С уже ослаблена, но еще не полностью разорвана, а связь А-В уже начала образовываться. Для большей наглядности можно построить график Е(потенциальная энергия) от R(координаты реакции). Для того, чтобы произошла реакция нужно, чтобы частицы имели энергию не меньше энергии активации.
Исходные вещества всегда находятся в равновесии с активированным комплексом.
При какой температуре наступит равновесие системы
СН4 (г) + СО2 (г) =2СО (г) + 2Н2 (г); энтальпия = +247,37 кДж.
Ответ: 961,9 К.
Решение:
Уравнение процесса имеет вид:
СН4 (г) + СО2 (г) =2СО (г) + 2Н2 (г); энтальпия= +247,37 кДж.
Значение энтропия находим из соотношения:
тепловой эффект
Значения энтропия находим из специальных таблиц, получим:
энтропия= [2S0 (СО) + 2S0 (Н2)] – [S0 (CH4)] + S0(СО)];
энтропия = (2 . 197,91) +2(130,59) – (186,19 + 213,65) = +257,16 Дж/моль . К.
Найдём температуру, при которой энергия гиббса = 0:
0 = энтальпия - Тэнтропия;
энтальпия= Т/энтропия ;
Т = энтальпия/энтропия = -247,37/0,25716 961,9 К.
Следовательно, при температуре 961,9 K начнется реакция взаимодействия диоксида углерода с метаном. Иногда эту температуру называют температурой начала реакции.
Ответ: 961,9 К.


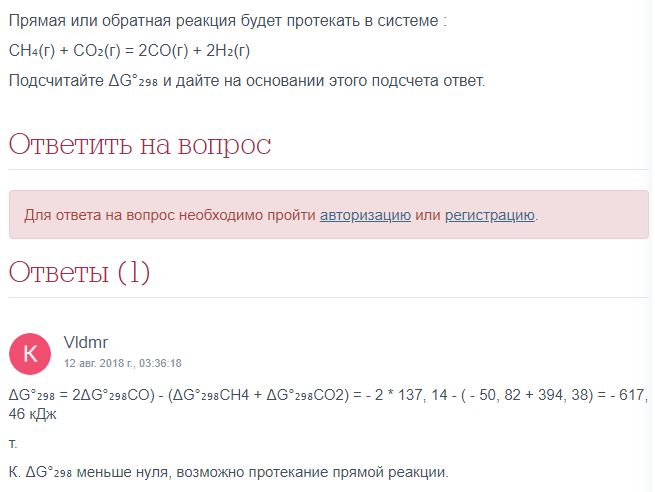
Определить, возможна ли реакция СН4 +1/2O2 = СН3ОН при стандартных условиях.
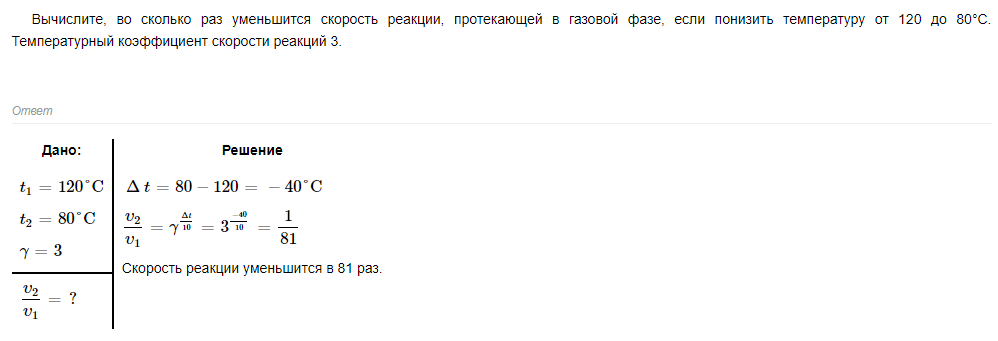
Вместо 3 должно быть 2,5
Скорость химической реакции измеряется изменением концентрации реагирующих веществ в единицу времени. Средняя скорость химической реакции в данный момент времени равна:
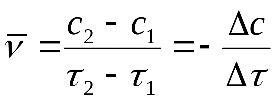
где и – концентрации исходного вещества в момент времени
и .
Скорость реакции в данный момент времени, т.е. мгновенную скорость можно выразить так:
= ±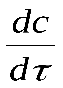
Скоростью гомогенной реакции называется количество вещества вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы:
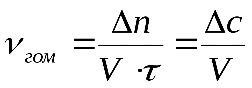
где – число молей вещества вступающего или образующегося в реакции.
–объем системы
- время реакции
Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы.
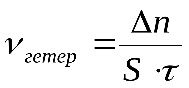
где - площадь поверхности фазы.
Важнейшими факторами, определяющими скорость химической реакции, являются: концентрация реагирующих веществ, характер среды, температура, катализатор, для газовых реакций – давление.
Согласно основному закону химической кинетики, закону действия масс (Гульдберг и Вааге, 1867 г.), скорость химической реакции, протекающей в гомогенной среде, пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов. Например, для реакции:
aА + bB cC + dD V = kl[А]a[B]b
где k – константа скорости химической реакции, постоянная, зависящая от природы реагирующих веществ и температуры процесса.
Скорость гетерогенных реакций зависит от площади поверхности раздела фаз. Например, для реакций:
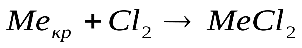
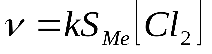
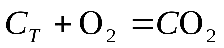
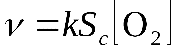
концентрации твердых веществ считают практически постоянными
, они входят в константу скорости.
Чтобы произошла химическая реакция между частицами системы (атомами, ионами, молекулами), необходимо их столкновение.
Но не каждое столкновение частиц приводит к взаимодействию: оно имеет место лишь в случае, когда частицы сближаются на такое расстояние, при котором происходит перекрывание их электронных облаков, а, следовательно, и перераспределение их электронной плотности; при этом одни связи разрушаются, а другие – образуются.
Для такого взаимодействия частицы должны обладать определенным избытком энергии (по сравнению со средней величиной энергии всех частиц), т.е. быть активными.
Избыточная энергия, которой должны обладать молекулы для того, чтобы при их столкновении могла произойти реакция, называется энергией активации. Она является основным фактором, определяющим скорость той или иной реакции: чем меньше энергия активации, тем быстрее при данной температуре будет протекать процесс.
Как следует из рис.1, в процессе химической реакции (I) аА + bB <=> cC + dD (II) система взаимодействующих частиц претерпевает энергетические изменения: ее энергия возрастает из исходного состояния (I), проходит через максимум (с точкой А) – «энергетический барьер», соответствующий переходному состоянию (его называют активированным комплексом), после чего быстро снижается и образует конечные продукты (II).
При этом разность между энергией переходного состояния (А) и энергией исходных веществ (I) есть энергия активации прямой реакции Е'ª, а разность между энергией переходного состояния (А) и энергией конечных продуктов (II) есть энергия активации обратной реакции Е''ª.
Разность энергий исходных веществ (I) и продуктов реакции (II) определяет теплоту реакции (ΔН). Реакции, протекающие с выделением тепла, называются экзотермическими. Реакции, протекающие с поглощением тепла, называются эндотермическими.
Р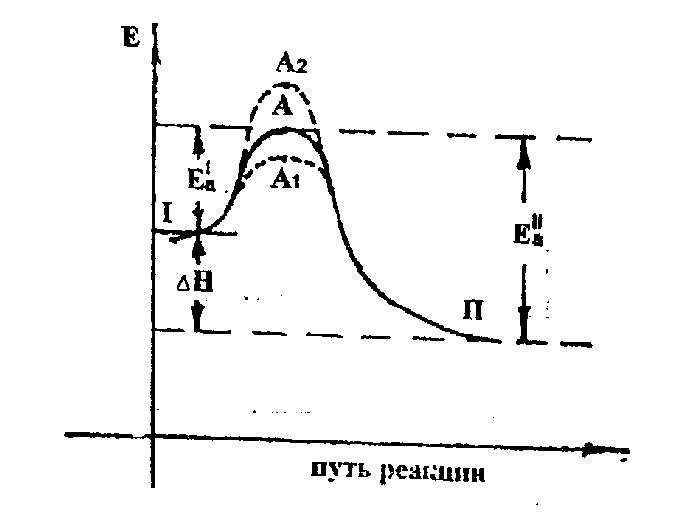 ис.1 Изменение потенциальной энергии системы при осуществлении химической реакции.
ис.1 Изменение потенциальной энергии системы при осуществлении химической реакции.
Энергетические барьеры ограничивают протекание реакций. Благодаря этому, многие в принципе возможные реакции (при (ΔG
Все внешние условия, например катализаторы
2) В реакции участвуют два реагента, начальные концентрации которых не равны:
Методы определения порядка реакции:
1)Метод подстановки основан на подстановке экспериментальных данных
2)Метод Вант-Гоффа: n=
3)По периоду полупревращения (не применимо для реакций первого порядка): n=
4)Графический метод: lnC от t (прямая линия): tga=n
16. Влияние температуры на скорость химической реакции. Правило Вант-Гоффа. Понятие о теории активных соударений. Уравнение Аррениуса. Энергия активации. Понятие об активированном комплексе. Аналитический и графический методы определения энергии активации.
Вант-Гофф установил, что при повышении температуры на 10К скорость реакции увеличивается в 2-4 раза. Коэффициент =
равен (-Еа/R). Также можно найти энергию активации, если известны константы скорости при двух температурах:
Еа=
В теории активированного комплекса для любой элементарной реакции предполагается. что начальная конфигурация атомов переходит в конечную в результате непрерывного изменения межъядерных расстояний.
Активированным комплексом называется промежуточная конфигурация системы А..В..С, в которой связь В-С уже ослаблена, но еще не полностью разорвана, а связь А-В уже начала образовываться. Для большей наглядности можно построить график Е(потенциальная энергия) от R(координаты реакции). Для того, чтобы произошла реакция нужно, чтобы частицы имели энергию не меньше энергии активации.
Исходные вещества всегда находятся в равновесии с активированным комплексом.
21 билет
При какой температуре наступит равновесие системы
СН4 (г) + СО2 (г) =2СО (г) + 2Н2 (г); энтальпия = +247,37 кДж.
Ответ: 961,9 К.
Решение:
Уравнение процесса имеет вид:
СН4 (г) + СО2 (г) =2СО (г) + 2Н2 (г); энтальпия= +247,37 кДж.
Значение энтропия находим из соотношения:
тепловой эффект
Значения энтропия находим из специальных таблиц, получим:
энтропия= [2S0 (СО) + 2S0 (Н2)] – [S0 (CH4)] + S0(СО)];
энтропия = (2 . 197,91) +2(130,59) – (186,19 + 213,65) = +257,16 Дж/моль . К.
Найдём температуру, при которой энергия гиббса = 0:
0 = энтальпия - Тэнтропия;
энтальпия= Т/энтропия ;
Т = энтальпия/энтропия = -247,37/0,25716 961,9 К.
Следовательно, при температуре 961,9 K начнется реакция взаимодействия диоксида углерода с метаном. Иногда эту температуру называют температурой начала реакции.
Ответ: 961,9 К.
22 билет

23 билет

24 билет

25 билет
Определить, возможна ли реакция СН4 +1/2O2 = СН3ОН при стандартных условиях.
26 билет

Вместо 3 должно быть 2,5
27 билет
Химическая кинетика
-
Понятие о скорости химической реакции. -
Зависимость скорости химичкой реакции от концентрации реагирующих веществ. -
Понятие об энергии активации. -
Зависимость скорости реакции от температуры. -
Катализ.
-
Понятие о скорости химической реакции.
Скорость химической реакции измеряется изменением концентрации реагирующих веществ в единицу времени. Средняя скорость химической реакции в данный момент времени равна:
где и – концентрации исходного вещества в момент времени
и .
Скорость реакции в данный момент времени, т.е. мгновенную скорость можно выразить так:
= ±
Скоростью гомогенной реакции называется количество вещества вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы:
где – число молей вещества вступающего или образующегося в реакции.
–объем системы
- время реакции
Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы.
где - площадь поверхности фазы.
-
Зависимость скорости реакции от концентрации реагирующих веществ.
Важнейшими факторами, определяющими скорость химической реакции, являются: концентрация реагирующих веществ, характер среды, температура, катализатор, для газовых реакций – давление.
Согласно основному закону химической кинетики, закону действия масс (Гульдберг и Вааге, 1867 г.), скорость химической реакции, протекающей в гомогенной среде, пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов. Например, для реакции:
aА + bB cC + dD V = kl[А]a[B]b
где k – константа скорости химической реакции, постоянная, зависящая от природы реагирующих веществ и температуры процесса.
Скорость гетерогенных реакций зависит от площади поверхности раздела фаз. Например, для реакций:
концентрации твердых веществ считают практически постоянными
, они входят в константу скорости.
-
Понятие об энергии активации.
Чтобы произошла химическая реакция между частицами системы (атомами, ионами, молекулами), необходимо их столкновение.
Но не каждое столкновение частиц приводит к взаимодействию: оно имеет место лишь в случае, когда частицы сближаются на такое расстояние, при котором происходит перекрывание их электронных облаков, а, следовательно, и перераспределение их электронной плотности; при этом одни связи разрушаются, а другие – образуются.
Для такого взаимодействия частицы должны обладать определенным избытком энергии (по сравнению со средней величиной энергии всех частиц), т.е. быть активными.
Избыточная энергия, которой должны обладать молекулы для того, чтобы при их столкновении могла произойти реакция, называется энергией активации. Она является основным фактором, определяющим скорость той или иной реакции: чем меньше энергия активации, тем быстрее при данной температуре будет протекать процесс.
Как следует из рис.1, в процессе химической реакции (I) аА + bB <=> cC + dD (II) система взаимодействующих частиц претерпевает энергетические изменения: ее энергия возрастает из исходного состояния (I), проходит через максимум (с точкой А) – «энергетический барьер», соответствующий переходному состоянию (его называют активированным комплексом), после чего быстро снижается и образует конечные продукты (II).
При этом разность между энергией переходного состояния (А) и энергией исходных веществ (I) есть энергия активации прямой реакции Е'ª, а разность между энергией переходного состояния (А) и энергией конечных продуктов (II) есть энергия активации обратной реакции Е''ª.
Разность энергий исходных веществ (I) и продуктов реакции (II) определяет теплоту реакции (ΔН). Реакции, протекающие с выделением тепла, называются экзотермическими. Реакции, протекающие с поглощением тепла, называются эндотермическими.
Р
 ис.1 Изменение потенциальной энергии системы при осуществлении химической реакции.
ис.1 Изменение потенциальной энергии системы при осуществлении химической реакции.Энергетические барьеры ограничивают протекание реакций. Благодаря этому, многие в принципе возможные реакции (при (ΔG
Все внешние условия, например катализаторы

