ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.10.2024
Просмотров: 101
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
4 билетИсточник: https://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/367.html
Гибридизация электронных облаков
Термодинамическая система и ее состояния
Параметры термодинамической системы
Функци состояния термодинамической системы
12. Химическое равновесие. Обратимые и необратимые реакции.
Характеристика растворов. Процесс растворения.
Давление насыщенного пара над раствором. Закон рауля.
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
Лекция по теме «Химические источники тока»
18 билет
Современная химия выделяет следующие типы химических связей:
-
металлическая; -
ковалентная; -
ионная; -
межмолекулярная.
Водородная связь
Водородная связь (Н-связь)– это связь, образуемая протонированным атомом водорода с сильноэлектроотцательным атомом той же или другой молекулы. В обычных условиях валентность водорода равна 1, и он способен обобществлять с другими атомами одну электронную пару, образуя ковалентную связь: атом водорода может присоединять электрон, образуя гидрид-ион Н+.
Атом водорода обладает особенностью, отличающей его от всех остальных атомов: отдавая свой электрон, он остается в виде ядра без электронов, т.е. в виде частицы, диаметр, которой в тысячи раз меньше диаметра остальных атомов. При отсутствии электронов ион Н+ не отталкивается электронными оболочками других атомов или ионов, а наоборот, притягивается; он может близко подходить к другим атомам, взаимодействовать с их электронами и даже внедряться в их электронные оболочки. В жидкостях Н+-ионы большей частью не сохраняется в виде самостоятельной частицы, а связываются с молекулами двух веществ: в воде с молекулами воды, образуя ион Н3О+-ион гидроксония; с молекулой аммиака – NH4+-ион аммония.
Будучи связанным с атомом одного из наиболее электроотрицательных элементов: с атомом фтора, кислорода, хлора и азота, атом водорода приобретает относительно высокий положительный заряд, не превышающий единицу. Так как этот заряд сосредоточен на чрезвычайно малом атомном остове, он сильно приближается к другому атому, несущему отрицательный заряд. Это вызывает образование довольно сильной диполь-дипольной связи с энергией 20-30 кДж/моль и больше. Водородная связь возникает в результате междипольного взаимодействия двух сильно полярных связей, принадлежащих различным молекулам или одной и той же молекуле. Она слабее обычной ковалентной связи, энергия которой составляет приблизительно 125-420 кДж/моль и может усиливаться вследствие взаимной поляризации связей
, обусловленной указанными особенностями водородного атома. Водородная связь (Н-связь) обозначается Х-Н××××Х.
Атом водорода, участвующий в водородной связи, может располагаться точно посередине между двумя сильноотрицательными атомами – симметричное расположение или же смещаться ближе к тому из них, который имеет большую электроотрицательность – несимметричное расположение.
Энергии водородной связи достаточно, чтобы при обычных и пониженных температурах вызывать заметную диссоциацию молекул. Фтористый водород даже вблизи температуры кипения имеет средний состав (HF)4. Ассоциация приводит к аномально высоким температурам плавления и кипения фтороводорода. Существование димера H2F2 объясняет образование кислых солей типа KHF2×NaHF2. Тот факт, что фтористоводородная кислота, в отличие от хлористоводородной, бромистоводородной и иодистоводородной, представляет собой слабую кислоту (Кд = 7×10-4) – тоже является следствием ассоциации молекул HF из-за водородных связей.
При наличии несимметричной водородной связи, которая возникает в соединениях кислорода и азота, водород располагается немного ближе к одному из двух соседствующих атомов, здесь межмолекулярная Н-связь. Каждая молекула Н2О участвует в образовании двух Н-связей, так что атом кислорода оказывается связанным с четырьмя атомами водорода. Ассоциированные молекулы воды образуют ажурную пространственную структуру, где каждый атом кислорода располагается в центре тетраэдра, а в углах находятся атомы водорода.
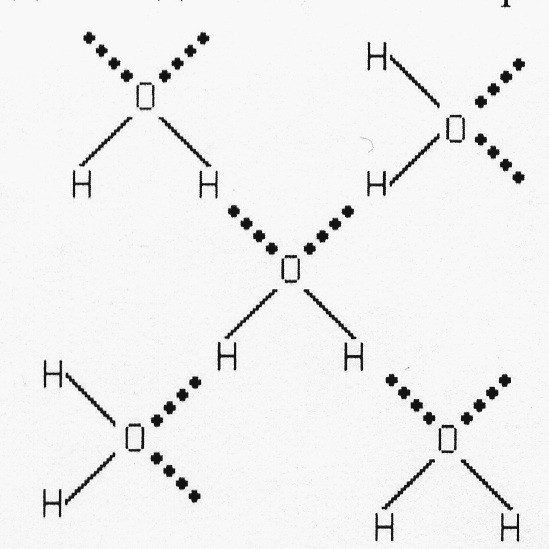
Ажурная пространственная структура воды
Ажурной структурой льда объясняется его меньшая плотность, чем воды. При плавлении часть Н-связей рвется и увеличивается плотность воды, т.к. молекулы располагаются более плотно. Рентгеновское исследование показало, что для большей части молекул в жидкой воде сохраняется также тетраэдрическое окружение: расположение соседних молекул почти такое же, как и в кристалле льда, а в последующем слое повторяется
некоторое отклонение от указанной упорядоченности; отклонение увеличивается по мере удаления от взятой молекулы. Для воды характерно наличие «ближнего порядка» как и для других жидкостей, и в меньшей степени, по сравнению с другими жидкостями, наличие «дальнего порядка». Этим объясняется наличие кристаллической структуры в воде.
Свойства воды такие как, большие значения теплоемкости и теплоты испарения, аномально высокие температуры плавления и кипения, высокая диэлектрическая проницаемость – из-за связанности молекул воды водородными связями. Без Н-связей tпл.воды = -100 оС, tкип.воды = -80 оС.
Водородные связи присутствуют в жидком аммиаке. Водородный атом, связанный с углеродом, может приобрести способность образовывать водородную связь, если остальные валентности углерода насыщаются сильно электроотрицательными атомами или соответствующими атомными группами, например, хлороформ (СНСl3), пентахлорэтан (CCl3-CHCl2), т.е. соседство электроотрицательных атомов может активировать образование водородной связи у атомов СН-групп, хотя электроотрицательность атомов С и Н почти одинакова. Этим объясняется возникновение Н-связей между молекулами в жидких HCN, CHF3 и др.
Водородная связь свойственна любым агрегатным состояниям вещества. Она образуется между одинаковыми и между различными молекулами, между различными частями одной и той же молекулы – внутримолекулярная водородная связь. Наиболее распространенной является Н-связь между молекулами, содержащими гидроксильные группы ОН-.
Простые эфиры даже с большей молярной массой более летучи, чем спирты, так как в эфирах все атомы водорода связаны с атомами углерода и не способны образовывать Н-связи.
Велика роль Н-связи в биохимических системах. Свойства белков и нуклеиновых кислот в значительной степени обусловлены наличием водородной связи. Н-связь играет большую роль в процессах растворения. Особенно распространены водородные связи в молекулах белков, нуклеиновых кислот и других биологически важных соединений, поэтому эти связи играют важную роль в химии процессов жизнедеятельности.
19 билет
Элементы химической термодинамики. Первый закон термодинамики. Термодинамические функции состояния системы – энтальпия и внутренняя энергия. Тепловой эффект реакции. Закон Гесса. Термохимические расчеты.
Элементы химической термодинамики.
На прошлой лекции мы закончили рассмотрение темы «Строение вещества» и теперь переходим к рассмотрению закономерностей протекания химических процессов.
Практически наиболее важными являются два типа закономерностей – энергетические и временные. Первые изучает химическая термодинамика, вторые – химическая кинетика.
Изначально термодинамика – это наука о «движении тепла». Она возникла в начале XIX века как теоретическая база создания тепловых машин (в основном, паровых котлов), послуживших основой промышленной революции.
Сейчас стало ясно, что термодинамика описывает энергетические состояния и их изменения в системах, состоящих из огромного числа элементов (тела состоят из атомов!) и находящихся в состоянии равновесия.
Химическая термодинамика – это обобщение термодинамики на случай, когда в системе протекают химические процессы.
Для нас важно осознать термодинамическое описание двух задач:
-
Энергетические характеристики термодинамических систем. -
Возможности предсказания направлений протекания самопроизвольных химических процессов и способов осуществления целенаправленных химических превращений.
Основные понятия термодинамики.
Понятие энергии – одно из основных физических понятий и потому не имеет исчерпывающего определения. Для наших целей примем, что энергия - это такая характеристика движения и взаимодействия тел, которая связана с их способностью совершать изменения в состоянии системы и внешней среды.
Видов энергии очень много – механическая, тепловая, электромагнитная, ядерная и т.д. Каждая из них может только видоизменяться, т.е. превращаться в другие виды энергии.
Термодинамическая система и ее состояния
Термодинамическая система – это ограниченная область пространства, занятая ее элементами. Важно, что ограниченная. Граница может быть и физической (стенки сосуда) и мысленной. Все, что вне системы – окружающая среда
Термодинамические системы бывают трех видов:
-
Изолированные (нет обмена ни веществом, ни энергией с окружающей средой). Пример – герметичный сосуд с газом с теплоизоляционной оболочкой, Вселенная в целом. -
Замкнутые (нет обмена веществом с окружающей средой). Пример – герметичный сосуд. -
Открытые (есть и энерго- и массообмен с окружающей средой). Пример – костер, человек.
В химической термодинамике изучаются только изолированные и замкнутые системы.
Различают равновесные и стационарные состояния систем. Равновесные системы самопроизвольно не изменяют своих состояний. Стационарные системы самопроизвольно не изменяют свою структуру.
Параметры термодинамической системы
Состояния систем характеризуются параметрами состояния и функциями состояния.
Параметры состояния системы – это набор независимых свойств, полностью характеризующих систему. Например, для идеального газа достаточно любых трех из четырех параметров – давления P, объёма V, температуры T и количества молей . Выбрав три, мы по уравнению состояния (в данном случае это будет уравнение Менделеева-Клапейрона) найдем четвертый:
PV= RT
Для более сложных систем могут появиться дополнительные параметры состояния – например, химический состав.
Параметры делятся на интенсивные и экстенсивные. Интенсивные параметры не зависят от количества вещества в системе (давление, температура, напряженность электрического поля и др.), а экстенсивные – зависят (объем, масса, заряд и др.)
Функци состояния термодинамической системы
Параметры состояния определяют функции состояния, тем или иным образом однозначно характеризующие энергию этого состояния. Однозначность проявляется в том, что функции состояния не зависят от истории системы, т.е. от того, как она попала в данное состояние.
Отметим пока в качестве примера такую функцию состояния системы как внутренняя энергия U.
Термодинамические процессы
Особую форму в термодинамике имеет время. Оно лишено такого своего качества, как длительность и проявляется только как изменение. В термодинамике не рассматривается ход процесса

