ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.10.2024
Просмотров: 94
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
4 билетИсточник: https://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/367.html
Гибридизация электронных облаков
Термодинамическая система и ее состояния
Параметры термодинамической системы
Функци состояния термодинамической системы
12. Химическое равновесие. Обратимые и необратимые реакции.
Характеристика растворов. Процесс растворения.
Давление насыщенного пара над раствором. Закон рауля.
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
Лекция по теме «Химические источники тока»
1 билет
С развитием квантовой химии периодический закон получил строгое теоретическое обоснование, а с ним и новую формулировку: "Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины зарядов ядер их атомов".
ОПЕЧАТКА! Нужно: "Как изменяется количество валентных электронов и максимальная степень окисления s- и р- элементов в периоде. Окислительно-восстановительные свойства и как это связано с порядковым номером и номером группы ?"
ОТВЕТ:
1. У s- и р-элементов валентные электроны находятся на внешнем уровне, поэтому всё предельно просто! С увеличением порядкового номера элемента количество валентных электронов увеличивается: у s-элементов 1 и 2 электрона (элементы I и II группы побочной группы, соответственно) , а у р-элементов - 3,4,5, 6, 7 (исключение кислород и фтор, эти высокоэлектроотрицательные элементы, могут только принимать электроны)
2. Максимальная степень окисления равна № группы (исключение кислород, фтор и инертные элементы)
3. Окислительные свойства связаны с способностью принимать электроны, энергия сродства к электрону (энергия, которая выделяется при присоединении электрона к атому) увеличивается в периоде слева на право. Окислительная способность увеличивается в том же направлении. р-Элементы, как правило, хорошие окислители. САМЫЙ СИЛЬНЫЙ ОКИСЛИТЕЛЬ F2. За ним следует молекулярный кислород.
4. Восстановительная способность атома связана с лёгкостью отдачи электрона. Энергия ионизации (энергия необходимая для отрыва электрона от атома) тоже увеличивается в периоде слева на право, но с другой скоростью. Восстановительная способность атомов элементов в этом же направлении уменьшается, требуются всё бОльшие и бОльшие затраты энергии. s-элементы - хорошие восстановители, р-элементы, как правило, - плохие восстановители, но есть исключения, например, водород (Н2).
2 билет
билет
Используя электронную формулу в нормальном и возбуждённом состоянии, объясните высшую степень окисления хлора
3 билет
Ответ: На внешнем энергетическом уровне у атома ванадия два электрона, а у мышьяка – пять электронов. Атомы типичных металлов характеризуются наличием небольшого числа
электронов на внешнем энергетическом уровне, а следовательно, тенденцией терять эти электроны. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем уровне содержат более трех электронов, обладают определенным сродством к электрону, а следовательно, приобретают отрицательную степень окисления и даже образуют отрицательные ионы. Таким образом, ванадий, как и все металлы, обладает только восстановительными свойствами, тогда как для мышьяка, проявляющего слабые восстановительные свойства, более свойственны окислительные. Общей закономерностью для всех групп, содержащих p- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у ванадия сильнее выражены, чем у мышьяка. Мышьяк относится к p-элементам поэтому с водородом он образует соединение с ковалентно-полярной связью (мышьяковистый водород – AsH3) такая связь практически всегда образует молекулярную кристаллическую решетку (связи в молекулах прочные, но между молекулами связи очень слабые), поэтому мышьяк способен образовывать газообразное соединение с водородом.
Источник: https://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/47.html
4 билет
Источник: https://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/367.html

5 билет
Такие свойства атомов, как их размер, энергия ионизации, сродство к электрону, электроотрицательность, связаны с электронной конфигурацией атома. В их изменении с увеличением порядкового номера элемента наблюдается периодичность.
Радиус атома – важная характеристика. Чем больше атомный радиус, тем слабее удерживаются внешние электроны. И наоборот, с уменьшением атомного радиуса электроны притягиваются к ядру сильнее.
В периоде атомный радиус в общем уменьшается слева направо. Это объясняется ростом силы притяжения электронов с ростом заряда ядра. В подгруппах сверху вниз атомный радиус возрастает, так как в результате прибавления дополнительного электронного слоя увеличивается объем атома, а значит, и его радиус.
Энергия ионизации – это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. При отрыве электрона от атома образуется соответствующий катион.
Энергия ионизации для элементов одного периода возрастает слева направо с возрастанием заряда ядра. В подгруппе она уменьшается сверху вниз вследствие увеличения расстояния электрона от ядра.
Атомы могут не только отдавать, но и присоединять электроны. При этом образуется соответствующий анион. Энергия, которая выделяется при присоединение к атому одного электрона, называется сродством к электрону.
Определение электроотрицательности дал американский ученый Л. Полинг. Он же предложил и первую шкалу электроотрицательности. Согласно Полингу, Электроотрицательность есть способность атома в соединении притягивать к себе электроны.
Окислительная активность в ряду H2O — H2S — H2Se — H2Te последовательно уменьшается, а восстановительные свойства – усиливаются. Объясняется это закономерным увеличением радиусов ионов ряду, что облегчает отдачу электронов. Поэтому кислород очень сильный окислитель, теллур – сильный восстановитель.
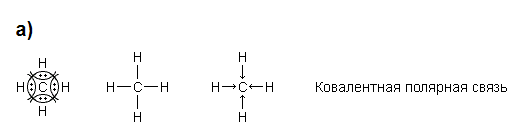
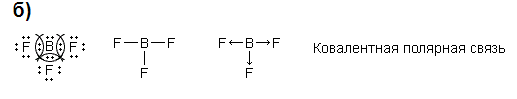
 6 билет
6 билет
HCl. Объяснение: Чем больше разность электроотрицательностей элементов, тем более полярной будет ковалентная связь.
7 билет
Насыщаемостьпроявляется в способности атома иметь максимальная ковалентность. Максимальная ковалентность это число связей, которое может дать атом за счет неспаренных электронов с учетом возбужденных состояний, с учетом ионизациии и с учетом донорно-акцепторного механизма образования связи. Так максимальная ковалентность атомов элементов первого периода равна единице (одна s-орбиталь), второго периода равна четырем (одна s-орбиталь и три p-орбитали). У атомов элементов третьего периода она увеличивается за счет свободных 3d-орбиталей до шести или девяти. Предела ковалентности не найдено.
Направленность объясняется тем, что электронные облака имеют определенную форму и ориентированы друг относительно друга под определенными углами. Молекулы, в связи с этим, имеют определенную геометрическую форму. В связи могут участвовать чистые орбитали и гибридные.
В молекуле следует различать центральный атом, вокруг которого координируются другие атомы (периферийные).
Если валентные возможности центрального атома в обычном состоянии позволяют образовать необходимое число сигма- и пи-связей электронами одного подуровня, то в связи участвуют чистые либо s-, либо p-орбитали.
В этом случае молекулы имеют линейную (участвуют в связи s-или p-орбитали), уголковую (участвуют две p-орбитали) или пирамидальную форму (участвуют три p-орбитали) молекул, с углом связи 1800 и 900 (Cl2, HCl, H2S, PH3 и т.д.).
Если в связи участвуют электроны разных подуровней, то вместо разных орбиталей возникают гибридные (концепция гибридизации Полинга).
Гибридизация это усреднение электронных облаков по форме и по энергии. Происходит гибридизация при приближении к центральному атому периферийных атомов. При этом гибридизации подвергаются орбитали центрального атома и вместо двух, трех, четырех, пяти и т.д. разных орбиталей возникают две, три, четыре, и т.д. гибридные орбитали.
Гибридизация становится невозможной, если орбитали сильно отличаются по энергии. Поэтому по группам ПС сверху вниз склонность к гибридизации уменьшается.
Типы гибридизации:
sp-гибридизация (гибридная орбиталь на 50% s и на 50% p), угол между орбиталями 1800 – форма расположения связей линейная (CO2, MgCl2 и т.д.);
sp2-гибридизация (гибридная орбиталь на 30% s и на 70% p), угол между орбиталями 1200 – форма расположения связей - плоский треугольник (BH3, AlCl3 и т.д.);
sp3-гибридизация (на 25% s и на 75% p), угол между связями 109,50 – форма расположения связей – тетраэдр (CH4, H2O, NH3 и т.д.);
sp3d-гибридизация, при этом образуются 5 гибридных орбиталей, три под углом 1200 в одной плоскости, а две под 900 перпендикулярно этой плоскости, форма расположения связей – тригональная бипирамида (PCl5, ClF3 и т.д.);
sp3d2-гибридизация, угол между орбиталями 900, форма расположения связей – октаэдр (SF6, PF6-) и т.д.
Правило определения типа гибридизации.
Тип гибридизации определяется числом сигма-связей + число неподеленных электронных пар. В гибридизации, таким образом, могут участвовать орбитали, содержащие неподеленные электронные пары ( H2O, NH3 и т.д.). От типа гибридизации зависит геометрия молекулы.
Поляризуемость ковалентной связи. Это способность связи становиться полярной, либо более полярной, под действием внешнего электрического поля.
Этим объясняется способность к диссоциации ковалентных молекул при растворении в воде. Вода – это полярная жидкость, в которой происходит поляризация ковалентной связи молекул растворенного вещества, вплоть до гетеролитического распада. Так молекула HCl ковалентная, но в воде диссоциирует на ионы (HCl →H+ + Cl-). По ряду галогеноводородных кислот поляризуемость усиливается и, несмотря на уменьшение полярности связи, сила кислот растет от HF к HI.