ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.10.2024
Просмотров: 120
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
4 билетИсточник: https://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/367.html
Гибридизация электронных облаков
Термодинамическая система и ее состояния
Параметры термодинамической системы
Функци состояния термодинамической системы
12. Химическое равновесие. Обратимые и необратимые реакции.
Характеристика растворов. Процесс растворения.
Давление насыщенного пара над раствором. Закон рауля.
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
Лекция по теме «Химические источники тока»
10 билет
Ну вообще-то координационная связь тут не между азотом и хлором, а между цинком и молекулами аммиака. Так что Zn - акцептор, а N - донор электронной пары.
[Zn(NH₃)₄]Cl₂ → [Zn(NH₃)₄]²⁺ + 2Cl⁻
Донорно-акцепторная связь
Рассмотренный в рамках модели Льюиса механизм образования ковалентной связи не является единственно возможным.
В ряде случаев электронные вклады участников процесса могут быть неравными: одна из взаимодействующих частиц (атом, ион или молекула) поставляет сразу два электрона – готовую электронную пару – в общее владение с партнером по взаимодействию (атомом, ионом или молекулой), а вторая частица не вносит электронов вообще. Частицы первого типа называются донорами электронной пары, частицы второго – акцепторами электронной пары.
В результате такого, называемого донорно-акцепторным, взаимодействия образуется обычная ковалентная связь, поэтому правильнее говорить не "до- норно-акцепторная связь", а "ковалентная связь, образованная по донорноакцепторному механизму". Различия между двумя механизмами образования ковалентной связи можно пояснить схемой:
| обменный механизм: | A . + . B → A : B |
| донорно-акцепторный | |
| механизм: | A: + B → A : B |
| | донор акцептор |
Характерный признак донорных свойств частиц – наличие у них электронных пар. Высокими донорными свойствами отличаются анионы галогенов (F-, Cl-, Br-, I-, At-), характеризующиеся восьмиэлектронной оболочкой – электронным октетом, цианид-анион СN-, гидроксид-анион OH-, многие другие анионы. Из нейтральных молекул значительными донорными свойствами обладают молекулы воды и аммиака. В молекуле H2O на атоме кислорода имеются две электронные пары, не занятые в образовании собственных химических связей в молекуле. Такие электронные пары называют неподеленными. Действительно, атом кислорода затрачивает только два из шести своих валентных электронов на образование связей O-H. В молекуле NH3 у атома азота имеется одна
неподеленная пара: на образование трех ковалентных связей N-H затрачено три из его пяти валентных электронов.
Согласно современным представлениям о донорно-акцепторном механизме образования ковалентной связи, электронные пары донора размещаются на вакантных (свободных от собственных электронов) орбиталях акцептора. Поэтому именно наличие таких свободных орбиталей у частицы и является показателем ее акцепторных свойств.
Классическим примером акцептора является катион водорода H+ – частица, лишенная электронов вообще. Взаимодействие катиона водорода с молекулами воды и аммиака приводит к образованию катионов гидроксония H3O+ и аммония NH4+, соответственно. Никакими экспериментальными методами исследования невозможно различить, какая из трех ковалентных связей в первом многоатомном ионе или какая из четырех – во втором образовались именно по донорно-акцепторному механизму.
Активные акцепторы – катионы переходных элементов, например: Cu2+, Fe3+, Co2+, Cr3+, Ni2+, Ag+ и т.п. Их акцепторные возможности обусловлены наличием свободных d-орбиталей. Акцепторные свойства характеризуют и катионы некоторых элементов других электронных семейств, например, Al3+, Be2+. Взаимодействие подобных акцепторов (не только катионов, но и нейтральных атомов) с разнообразными донорами приводит к возникновению особого класса химических соединений, называемых комплексными соедине-
ниями.
Химическую связь в комплексах называют координационной связью. Координационная связь чаще всего имеет преимущественно ковалентный характер, причем кратность ковалентной связи может быть > 1.
Центральные атомы (чаще всего в их роли выступают катионы или нейтральные атомы металлов) в комплексных соединениях называют комплексообразователями, а координирующиеся вокруг них частицы – лигандами. Число лигандов определяет значение координационного числа комплексообразователя. В формуле комплексного соединения различают внутреннюю (ком-
плексный ион – комплексообразователь + лиганды) и внешнюю сферы. Первоначально образующийся комплексный ион (в зависимости от образующих его частиц он может быть катионом или анионом) электростатически взаимодействует с какими-либо простыми ионами, образуя с ними ионные связи. В химической формуле последний процесс отображается включением в внешнюю сферу координационой формулы противоионов для обеспечения ее электронейт-
ральности. Например: K3[Fe(CN)6], [Cu(NH3)4]SO4, Na[Al(OH)4]. В ряде случаев координация лигандов относительно комплексообразователя приводит к образованию нейтральной системы. В этом случае внешняя сфера в координационной формуле отсутствует. Например: [Cr(H2O)3Cl3], [Co(NH3)3(NO2)3].
Комплексные соединения находят широкое практическое применение в самых разнообразных областях науки и техники, играют значительную роль в живой природе. Так, гемоглобин и хлорофилл представляют собой координационные металлоорганические соединения. Комплексообразователями в них являются железо и магний, соответственно. Гемоглобин представляет собой гем (комплекс железа и органических лигандов), связанный с белком (глобином). Белковая часть гемоглобина неодинакова у различных живых организмов, а гем – един для всех (и для человека, и для кита, и для мухи). Определенная концентрация гемоглобина в крови – жизненно важный параметр для организма. Гемоглобин является переносчиком кислорода: в ходе биологических процессов с его участием происходит попеременное присоединение и высвобождение молекулы кислорода. Некоторые химические соединения, например сероводород или угарный газ (оксид углерода II), способны образовать с гемоглобином более прочные химические связи, чем кислород. Именно этим объясняется их токсичность, особенно высокая у угарного газа, легко образующегося в процессах горения (например, при пожаре). Угарный газ образует устойчивый комплекс с гемоглобином, блокирует его функцию переносчика кислорода в организме, вызывая его смерть.
11 билет
Схема образования химической связи в молекуле азота.
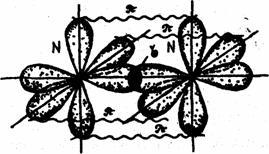
В молекуле азота связь осуществляется за счет перекрывания трех р-облаков, расположенных по оси х, у, z. Между атомами азота образуется одна сигма (σ) -связь и две пи – связи (π). Связь, образованная при перекрывании электронных облаков вдоль линии, соединяющей центры взаимодействующих атомов, называется сигма (σ) - связью. Связь, образованная за счет перекрывания орбиталей по обе стороны от линии, соединяющей центры – атомов, называется пи – связью.
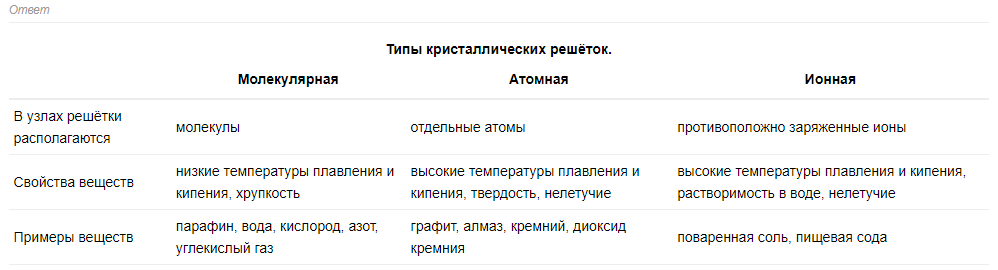 12 билет
12 билет
13 билет
Ионная связь– связь за счет электростатического взаимодействия противоположно заряженных ионов: катионов и анионов. Ионная связь возникает при взаимодействии атомов с разностью электроотрицательности > 2. В этом случае за счет смещения электронной плотности атомы превращаются в ионы (электронная пара полностью переходит во владение наиболее электроотрицательного атома) Rb + F → Rb+ : F-
NaCl; χ (Na)=0,9; χ (Cl)=3,1; χ =χ (Cl)- χ (Na)=3.1-0.9=-2,2.
Ионы-это заряженные частицы, превращающиеся в атомы путем принятия или отдачи электронов. Ионы принято рассматривать , как заряды со сферической симметрией силового поля, а взаимодействие таких зарядов ненасыщаемо и ненаправляемо.
Каждый ион в ионном кристалле окружает себя на близком расстоянии таким числом противо-ионов, которое может геометрически разместить.
Понятие молекулы для ионного соединения : из-за ненасыщенности и ненаправленности молекулы ионной связи носят условный характер.
Формула в молекуле ионного соединения показывает лишь простейшие соотношения между количествами катионов и анионов в макрокристалле вещества.
Строение
1

