ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.10.2024
Просмотров: 149
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
4 билетИсточник: https://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/367.html
Гибридизация электронных облаков
Термодинамическая система и ее состояния
Параметры термодинамической системы
Функци состояния термодинамической системы
12. Химическое равновесие. Обратимые и необратимые реакции.
Характеристика растворов. Процесс растворения.
Давление насыщенного пара над раствором. Закон рауля.
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
Лекция по теме «Химические источники тока»
, которое характеризуется константой сорбционного равновесия (Кс).
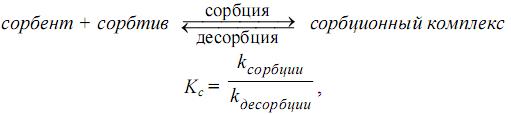
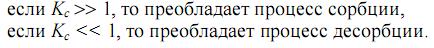
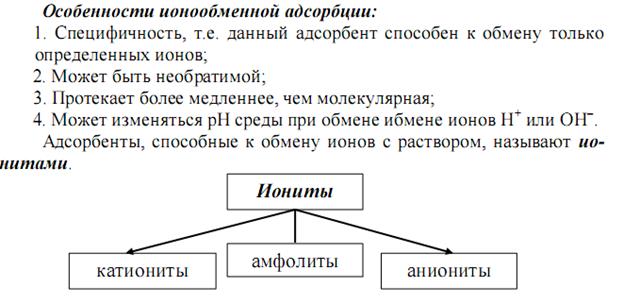
В зависимости от механизма сорбции различают:
- адсорбцию (поглощение поверхностью). Адсорбция уменьшается с повышением температуры. Адсорбироваться могут любые вещества.
- абсорбцию (поглощение в объеме). Примером процесса абсорбции являются растворение газов в жидкостях.
- хемосорбцию (поглощение, сопровождаемое протеканием химических реакций). Например, поглощение NH3 или хлористого водорода водой, поглощение влаги и кислорода металлами с образованием оксидов и гидроксидов, поглощение диоксида углерода оксидом кальция.
- капиллярную конденсацию – переход поглощаемого газа или пара в жидкое состояние в узких порах адсорбента (т.е. ожижение паров в микропористых сорбентах).
- Во многих случаях все эти виды сорбции наблюдаются одновременно.
В качестве сорбента используют твердые фазы с высокоразвитой поверхностью – активированный уголь, кремнезем (силикагель), оксиды и гидроксиды металлов, их соли, синтетические полимерные вещества и др.
ПАВ – поверхностно-активные вещества – это вещества,, понижающие поверхностное натяжение или согласно уравнению Гиббса, обладающие положительной адсорбцией. Их молекулы дифильны, т.е. содержат одновременно полярную группу (-ОН, - СООН, -NH2, -SO3H и др.) и неполярную углеводородную цепь (с тр. 244 Зеленин)
Адсорбция зависит от природы и удельной поверхности адсорбента, концентрации и природы адсорбтива, природы растворителя, а также температуры (стр.781, Попков).
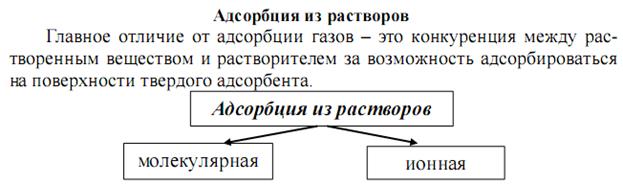
Слесарев стр. 692.


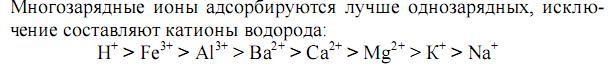


Слесарев стр. 695

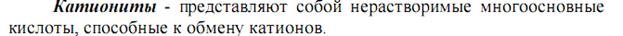
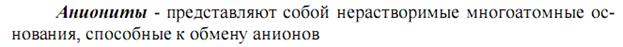

Ионнобменные реакции выражается уравнениями6
Для катионита -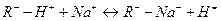
Для анионита -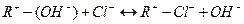
Активность ионитов –поглощающая способность, характеризующаяся обменной ёмкостью, -количеством ионов (моль), связанных 1 г сухого ионита из раствора в равновесных условиях.
Растворы имеют важное значение в жизни и практической деятельности человека. Так, процессы усвоения пищи человеком и животными связаны с переводом питательных веществ в раствор. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа). Производства, в основе которых лежат химические процессы, обычно связаны с использованием растворов.
Раствором называется твердая или жидкая гомогенная система, состоящая из двух или более компонентов, относительные количества которых могут изменяться в широких пределах. Наиболее важный вид растворов – жидкие растворы.
Растворы состоят из растворенных веществ и растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде молекул или ионов. Обычно растворителем считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор (водный раствор соли). Если оба компонента до растворения находились в одинаковом агрегатном состоянии (спирт и вода), то растворителем считается тот компонент, находящийся в большем количестве.
Рассмотрим процесс растворения твердого компонента в жидком растворителе. При растворении кристалла в жидкости одновременно происходит два процесса:
– само растворение вещества за счет отрыва отдельных молекул от его поверхности, которые благодаря диффузии равномерно распределяются по всему объему растворителя. Отделение молекул от поверхности твердого тела вызывается их собственным колебательным движением и притяжением со стороны молекул растворителя. Этот процесс должен был бы продолжаться до полного растворения любого количества кристаллов, если бы не происходил противоположный процесс;
– обратная кристаллизация растворенного вещества, скорость которой тем больше
, чем выше его концентрация в растворе.
При равенстве скоростей растворения и кристаллизации устанавливается динамическое растворение при котором в данном растворителе нельзя растворить дополнительное количество вещества. Такой раствор называется насыщенным и концентрация растворенного вещества является концентрацией насыщения.
В большинстве случаев используют ненасыщенные растворы, в которых можно растворить дополнительное количество вещества. Такие растворы подразделяются на следующие:
– разбавленные растворы, в которых концентрация растворенного вещества несоизмеримо мала по сравнению с концентрацией раствора (менее 0,01%);
– концентрированные растворы, в которых соизмеримы концентрации растворителя и растворенного вещества (более 0,01%).
Также существуют пересыщенные растворы, в которых концентрация растворенного вещества выше концентрации насыщения.
Вспомнить способы выражения концентрации растворов:
1) Массовая доля.
2) Мольная доля.
3) Молярная концентрация.
4) Нормальная концентрация.
5) Мольная доля.
Большинство веществ, находящихся в кристаллическом состоянии, растворяются в жидкостях с поглощением теплоты, однако при растворении некоторых веществ (гидроксид натрия, безводный сульфат меди) теплота выделяется. При этом меняется энтальпия системы.
Изменение энтальпии при растворении одного моля вещества, называется энтальпией растворения этого вещества.
ΔH<0 при выделении теплоты, ΔH>0 при поглощении теплоты.
Процесс растворения сопровождается значительным возрастанием энтропии системы, так как в результате равномерного распределения частиц одного вещества в другом резко увеличивается число микросостояний системы. Поэтому, несмотря на эндотермичность растворения большинства кристаллов, изменение энергии Гиббса системы при растворении отрицательно и процесс протекает самопроизвольно.
При растворении кристаллов происходит их разрушение, что требует затрат энергии. Поэтому растворение должно было бы сопровождаться поглощением теплоты. Если же наблюдается обратный эффект, то это показывает, что одновременно с растворением происходит какое-то взаимодействие между растворителем и растворены веществом, при котором выделяется в виде теплоты больше энергии, чем ее расходуется на разрушение кристаллической решетки.
В настоящее время установлено, что при растворении многих веществ их молекулы (или) ионы связываются с молекулами растворителя, образуя соединения, называемые сольватами. Этот процесс называется сольватацией. В случае, когда растворителем является вода, эти соединения называются гидратами, а сам процесс их образования – гидратацией.
Гидраты, как правило, нестойкие соединения, во многих случаях разлагающиеся уже при выпаривании растворов. Но иногда они настолько прочны, что при выделении растворенного вещества из раствора вода входит в состав его кристаллов. Такие вещества называют кристаллогидратами, а вода, которая в них содержится – кристаллизационной (CuSO4•5H2O – медный купорос, Na2SO4•10H2O – глауберова соль).
Прочность связи между веществом и кристаллизационной водой в кристаллогидратах различна. Многие из них теряют кристаллизационную воду уже при комнатной температуре (Na2CO3•10H2O). Для обезвоживания других кристаллогидратов требуется довольно сильное нагревание (CuSO4•5H2O). А для некоторых никакими путями нельзя удалить воду, чтобы получить безводную соль (AlCl3•6H2O).
Процесс образования гидратов протекает с выделением теплоты. При растворении вещества, подвергающегося гидратации, общий тепловой эффект складывается из теплового эффекта разрушения кристаллической решетки твердого растворяемого вещества (эндотермический процесс) и теплового эффекта гидратации (экзотермический процесс). При этом он может принимать как положительное так и отрицательное значение.
0>
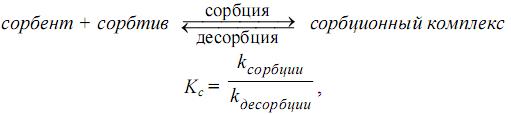
В зависимости от механизма сорбции различают:
- адсорбцию (поглощение поверхностью). Адсорбция уменьшается с повышением температуры. Адсорбироваться могут любые вещества.
- абсорбцию (поглощение в объеме). Примером процесса абсорбции являются растворение газов в жидкостях.
- хемосорбцию (поглощение, сопровождаемое протеканием химических реакций). Например, поглощение NH3 или хлористого водорода водой, поглощение влаги и кислорода металлами с образованием оксидов и гидроксидов, поглощение диоксида углерода оксидом кальция.
- капиллярную конденсацию – переход поглощаемого газа или пара в жидкое состояние в узких порах адсорбента (т.е. ожижение паров в микропористых сорбентах).
- Во многих случаях все эти виды сорбции наблюдаются одновременно.
В качестве сорбента используют твердые фазы с высокоразвитой поверхностью – активированный уголь, кремнезем (силикагель), оксиды и гидроксиды металлов, их соли, синтетические полимерные вещества и др.
ПАВ – поверхностно-активные вещества – это вещества,, понижающие поверхностное натяжение или согласно уравнению Гиббса, обладающие положительной адсорбцией. Их молекулы дифильны, т.е. содержат одновременно полярную группу (-ОН, - СООН, -NH2, -SO3H и др.) и неполярную углеводородную цепь (с тр. 244 Зеленин)
Адсорбция зависит от природы и удельной поверхности адсорбента, концентрации и природы адсорбтива, природы растворителя, а также температуры (стр.781, Попков).

Слесарев стр. 692.


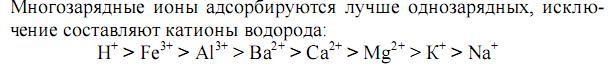


Слесарев стр. 695



Ионнобменные реакции выражается уравнениями6
Для катионита -
Для анионита -
Активность ионитов –поглощающая способность, характеризующаяся обменной ёмкостью, -количеством ионов (моль), связанных 1 г сухого ионита из раствора в равновесных условиях.
43 билет
Растворы.
Растворы имеют важное значение в жизни и практической деятельности человека. Так, процессы усвоения пищи человеком и животными связаны с переводом питательных веществ в раствор. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа). Производства, в основе которых лежат химические процессы, обычно связаны с использованием растворов.
Характеристика растворов. Процесс растворения.
Раствором называется твердая или жидкая гомогенная система, состоящая из двух или более компонентов, относительные количества которых могут изменяться в широких пределах. Наиболее важный вид растворов – жидкие растворы.
Растворы состоят из растворенных веществ и растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде молекул или ионов. Обычно растворителем считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор (водный раствор соли). Если оба компонента до растворения находились в одинаковом агрегатном состоянии (спирт и вода), то растворителем считается тот компонент, находящийся в большем количестве.
Рассмотрим процесс растворения твердого компонента в жидком растворителе. При растворении кристалла в жидкости одновременно происходит два процесса:
– само растворение вещества за счет отрыва отдельных молекул от его поверхности, которые благодаря диффузии равномерно распределяются по всему объему растворителя. Отделение молекул от поверхности твердого тела вызывается их собственным колебательным движением и притяжением со стороны молекул растворителя. Этот процесс должен был бы продолжаться до полного растворения любого количества кристаллов, если бы не происходил противоположный процесс;
– обратная кристаллизация растворенного вещества, скорость которой тем больше
, чем выше его концентрация в растворе.
При равенстве скоростей растворения и кристаллизации устанавливается динамическое растворение при котором в данном растворителе нельзя растворить дополнительное количество вещества. Такой раствор называется насыщенным и концентрация растворенного вещества является концентрацией насыщения.
В большинстве случаев используют ненасыщенные растворы, в которых можно растворить дополнительное количество вещества. Такие растворы подразделяются на следующие:
– разбавленные растворы, в которых концентрация растворенного вещества несоизмеримо мала по сравнению с концентрацией раствора (менее 0,01%);
– концентрированные растворы, в которых соизмеримы концентрации растворителя и растворенного вещества (более 0,01%).
Также существуют пересыщенные растворы, в которых концентрация растворенного вещества выше концентрации насыщения.
Вспомнить способы выражения концентрации растворов:
1) Массовая доля.
2) Мольная доля.
3) Молярная концентрация.
4) Нормальная концентрация.
5) Мольная доля.
Гидраты и кристаллогидраты.
Большинство веществ, находящихся в кристаллическом состоянии, растворяются в жидкостях с поглощением теплоты, однако при растворении некоторых веществ (гидроксид натрия, безводный сульфат меди) теплота выделяется. При этом меняется энтальпия системы.
Изменение энтальпии при растворении одного моля вещества, называется энтальпией растворения этого вещества.
ΔH<0 при выделении теплоты, ΔH>0 при поглощении теплоты.
Процесс растворения сопровождается значительным возрастанием энтропии системы, так как в результате равномерного распределения частиц одного вещества в другом резко увеличивается число микросостояний системы. Поэтому, несмотря на эндотермичность растворения большинства кристаллов, изменение энергии Гиббса системы при растворении отрицательно и процесс протекает самопроизвольно.
При растворении кристаллов происходит их разрушение, что требует затрат энергии. Поэтому растворение должно было бы сопровождаться поглощением теплоты. Если же наблюдается обратный эффект, то это показывает, что одновременно с растворением происходит какое-то взаимодействие между растворителем и растворены веществом, при котором выделяется в виде теплоты больше энергии, чем ее расходуется на разрушение кристаллической решетки.
В настоящее время установлено, что при растворении многих веществ их молекулы (или) ионы связываются с молекулами растворителя, образуя соединения, называемые сольватами. Этот процесс называется сольватацией. В случае, когда растворителем является вода, эти соединения называются гидратами, а сам процесс их образования – гидратацией.
Гидраты, как правило, нестойкие соединения, во многих случаях разлагающиеся уже при выпаривании растворов. Но иногда они настолько прочны, что при выделении растворенного вещества из раствора вода входит в состав его кристаллов. Такие вещества называют кристаллогидратами, а вода, которая в них содержится – кристаллизационной (CuSO4•5H2O – медный купорос, Na2SO4•10H2O – глауберова соль).
Прочность связи между веществом и кристаллизационной водой в кристаллогидратах различна. Многие из них теряют кристаллизационную воду уже при комнатной температуре (Na2CO3•10H2O). Для обезвоживания других кристаллогидратов требуется довольно сильное нагревание (CuSO4•5H2O). А для некоторых никакими путями нельзя удалить воду, чтобы получить безводную соль (AlCl3•6H2O).
Процесс образования гидратов протекает с выделением теплоты. При растворении вещества, подвергающегося гидратации, общий тепловой эффект складывается из теплового эффекта разрушения кристаллической решетки твердого растворяемого вещества (эндотермический процесс) и теплового эффекта гидратации (экзотермический процесс). При этом он может принимать как положительное так и отрицательное значение.
0>

