ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.10.2024
Просмотров: 140
Скачиваний: 0
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
4 билетИсточник: https://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/367.html
Гибридизация электронных облаков
Термодинамическая система и ее состояния
Параметры термодинамической системы
Функци состояния термодинамической системы
12. Химическое равновесие. Обратимые и необратимые реакции.
Характеристика растворов. Процесс растворения.
Давление насыщенного пара над раствором. Закон рауля.
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
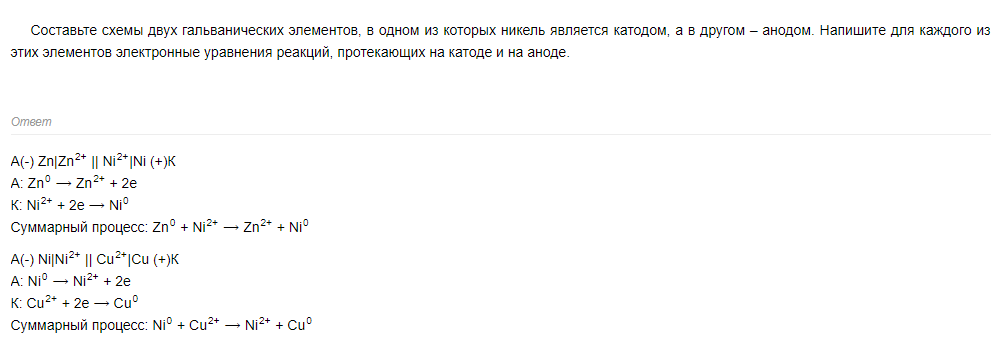
Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
Лекция по теме «Химические источники тока»
Водородный электрод применяют как электрод сравнения.

Рисунок к ст. Водородный электрод.
СТАНДАРТНЫЙ ПОТЕНЦИАЛ (нормальный потенциал), значение электродного потенциала, измеренное в стандартных условиях относительно выбранного электрода сравнения (стандартного электрода). Обычно стандартные потенциалы находят в условиях, когда термодинамич. активности а всех компонентов потенциалопределяющей р-ции, протекающей на исследуемом электроде, равны 1, а давление газа (для газовых электродов) равно 1,01 · 105 Па (1 атм). Для водных р-ров в качестве стандартного электрода используют водородный электрод (Pt; H2 [1,01·105Па], Н+ [a=1]), потенциал к-рого при всех т-рах принимается равным нулю (см. Электроды сравнения): стандартный потенциал равен эдс электрохимической цепи, составленной из исследуемого и стандартного электродов. Согласно рекомендациям ИЮПАК (1953), при схематич. изображении цепи (гальванич. ячейки) водородный электрод всегда записывается слева, исследуемый-справа. Потенциал исследуемого электрода считается положительным, если в режиме "источник тока" слева направо во внеш. цепи движутся электроны, а в р-ре - положительно заряженные частицы. Напр., стандартный потенциал хлорсеребряного электрода равен эдс гальванич. ячейки
-Pt, Н2[1,01·105Па]|НС1(аb=l)|AgCl, Ag|Pt +
Для любой электродной р-ции, включающей перенос n электронов, электродный потенциал определяется ур-нием:
где Е°-стандартный потенциал электрода, R-газовая постоянная, Т-абс. т-ра, F- постоянная Фарадея, аi-термодинамич. активность частиц (как заряженных, так и незаряженных), участвующих в электродной р-ции, vi-стехиометрич. коэффициенты (положит. числа для продуктов р-ций и отрицат. числа для исходных в-в, если при записи стехиометрич. ур-ния элек-трохим. процесса электроны входят в левую часть ур-ния, напр. AgCl + е : Ag + С1-). Значения стандартных потенциалов для ряда электродных процессов в водной среде приведены в таблице в порядке убывания окислит. способности соответствующих систем. Стандартные потенциалы металлов и водорода, расположенные в порядке их возрастания, составляют электрохимический ряд напряжений.
Стандартный потенциал определяется либо непосредственными измерениями эдс соответствующих электрохим. цепей с экстраполяцией на бесконечно разб. р-ры, либо расчетом - по данным о стандартных значениях изменения энергии Гиббса хим. р-ции DG0. В последнем случае р-цию представляют в виде суммы двух (или более) электродных р-ций, одна из к-рых -окис-лит.-восстановит. р-ция с искомым стандартным потенциалом
Из уравнения следует, что стандартные потенциалы, в свою очередь, м.б. использованы для расчета DG0 и константы равновесия К р-ции (ln К = — DG°/RT). Значения E0, рассчитанные на основе значений DG0, представлены в таблице; они далеко не всегда м. б. реализованы в электрохим. цепях из-за того, что предполагаемое равновесие электродной р-ции в действительности может не устанавливаться (это характерно для щелочных, щел.-зем. металлов и большинства орг. в-в в водных р-рах).
В неводных р-рителях стандартные потенциалы также определяют по отношению к потенциалу водородного электрода для каждого отдельного р-рителя. Ведется поиск стандартного электрода, потенциал к-рого можно было бы считать практически не зависящим от природы р-рителя, что позволило бы создать единую шкалу электродных потенциалов. В качестве таких электродов предложены системы: рубидий/ион рубидия, ферроцен/ферроциний-катион и бис(дифенил)хром(I)/ /бис(дифенил)хром(0), потенциалы к-рых из-за большого размера ионов и соотв. малой их сольватации незначительно (по сравнению с потенциалом водородного электрода) зависят от природы р-рителя. Последние два электрода рекомендованы в 1984 ИЮПАК в качестве электродов сравнения в неводных орг. средах.
Выбор электрода сравнения и стандартного состояния исследуемого электрода в системах с расплавами и твердым электролитом в большой мере определяется природой как исследуемого электродного процесса, так и ионного проводника. В широко используемых в качестве электролитов расплавах хлоридов металлов
стандартный потенциал берется в хлорной шкале, т. е. в качестве стандартного пользуются хлорным электродом в расплавленном хлориде (графит, Сl2 [1,01 · 105 Па], MC1z [расплав]), где М-металл (на практике обычно берут смесь хлоридов металла). Активность катионов Мz+ в индивидуальном расплаве принимается равной 1. В ряде высокотемпературных гальванич. элементов с твердым электролитом в качестве электрода сравнения применяют оксидные электроды, в частности вюститовый (Pt; Fe, FeO).
65 билет
Е 298 K = +1.45+1.984*10^-4*(298/2)*lg (10^-4)^4/0.1 = +1.006576 В.
https://www.liveexpert.org/topic/view/1523638-rasschitajte-ravnovesnij-potencial-elektroda-na-kotorom-protekaet-reakciya-po-uravneniyu-pbo2-4h-2e-pb2-2h2o-standartnij-potencial-raven-1
66 билет
67 билет
68 билет
Электролиз расплавов и растворов солей. Катодные и анодные процессы. Законы Фарадея.
Электролиз— совокупность окислительно-восстановительных процессов, протекающих на электродах при прохождении электрического тока через расплав или раствор электролита.
Анодом при электролизе называется положительный электрод, катодом — отрицательный. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
На катоде, происходит процесс восстановления (принятие электронов). На аноде идет процесс окисления (отдача электронов).
Электролиз расплавов
| 1) Расплав NaCl (t=850ºC) 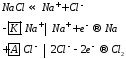 | 2) Расплав KOH 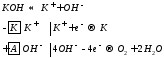 |
Электролиз водных растворов
На процессе электролиза в водных растворах влияние оказывают продукты диссоциации воды
Катодный процесс
Поведение катионов металлов при электролизе зависит от расположения металла в ряду активности, возможны 3 случая:
а) катионы металлов (от Li+ по Al3+) не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды;
б) катионы металлов (от Sn2+ по Au+) полностью восстанавливаются на катоде;
в) катионы металлы средней части ряда от (Al3+ до Sn2+) восстанавливаются на катоде одновременно с молекулами воды.
Вода на катоде (-)
А) кислая среда рН<7
Б) нейтральная и щелочная рН>=7
Анодный процесс
Аноды могут быть растворимые (активные) и нерастворимые (инертные).
Активные аноды изготавливают металлов (из меди, серебра, железа), они сами растворяются, т.е. окисляются при электролизе.
Инертные аноды из угля, графита, платины, они не окисляются, т.е. не растворяются при электролизе, а служат для передачи электродов во внешнюю цепь. На инертном аноде происходит окисление анионов раствора или молекул воды. При этом анионы бес кислородных кислот легко окисляются, а вместо кислородосодержащих анионов окисляется вода.
| Cl-, Br-, I-, S2- окисляются сами | NO3-, SO42-, PO43-, CO32- окисляются молекулы воды |
Вода на аноде (+)
А) щелочная среда рН>7
Б) нейтральная и кислая среда

