Файл: I. Периодический закон, периодическая система химических элементов в свете теории строения атомов.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 26.04.2024
Просмотров: 219
Скачиваний: 0
СОДЕРЖАНИЕ
Тип урока Комбинированный урок.
Тип урока Лабораторно-практическое занятие. Урок закрепление.
Тип урока Комбинированный урок.
Тип урока Лабораторно-практическое занятие. Урок закрепление
Тема занятия: Понятие о скорости химической реакции. Катализаторы. Химическое равновесие
Тип урока: Урок сообщений новых знаний
Тип урока Комбинированный урок.
Тип урока Лабораторно-практическое занятие. Урок закрепление
Тип урока Урок систематизации и обобшения.
Тип урока Комбинированный урок.
Тип урока Комбинированный урок.
Тип урока Комбинированный урок.
Тип урока Лабораторно-практическое занятие. Урок закрепление
Тип урока Лабораторно-практическое занятие. Урок закрепление
Тип урока Комбинированный урок.
Тип урока Лабораторно-практическое занятие. Урок закрепление
Тип урока Контроль знаний и умений.
Тип урока Урок комбинированный.
Тип урока Урок комбинированный.
Тип урока Урок комбинированный.
Тип урока Урок комбинированный.
Тип урока Урок комбинированный.
Тип урока Лабораторно-практическое занятие. Урок закрепление.
Тема занятий Спирты, классификация. Функциональная группа, ее электронное строение
Тема занятий Многоатомные спирты. Получение и применение
Тема занятий Фенол. Строение, физические и химические свойства
Тема занятий Альдегиды.Состав и строение альдегидов. Хиимические свойства и получение.
Тема занятий Карбоновые кислоты, строение.
Тема занятий Физические и химические свойства карбоновых кислот.
транс-1 –хлорпропен цис -1-хлорпропен
Ответ. 4 изомера.
Задача 4. При взаимодействии 11,2 л (н.у.) смеси изомерных углеводородов, представляющих собой газы с плотностью по водороду 21, с бромной водой получено 40,4 г соответствующего дибромпроизводного. Определите строение этих углеводородов и содержание каждого из них в смеси (в % по объему).
Решение. Молярная масса изомерных углеводородов равна: M(СхНу) = 21*2 = 42 г/моль, следовательно, углеводороды имеют формулу С3Н6. Такую молекулярную формулу имеют два вещества - пропен и циклопропан. Пропен реагирует с бромной водой:
СН3 - СН = СН2 + Вr2 → СН3 – СНВr - СН2Вr.
Молярная масса дибром производного равна: М(С3Н6Вr2) = 202 г/моль, а его количество: v(C3H6Br2) = 40,4/202 = 0,2 моль. Следовательно, в исходной смеси было 0,2 моль пропена. Общее количество углеводородов в смеси было равно 11,2/22,4 = 0,5 моль; оставшиеся 0,3 моль приходятся на долю циклопропана, который не взаимодействует с бромной водой.
Объемные доли газов в смеси равны их мольным долям: ( пропена) = 0,2/0,5 = 0,4, или 40%, (циклопропана) = 0,6, или 60%,
Ответ. 40% пропена, 60% циклопропана.
Задача 5. При пропускании алкена через избыток раствора перманганата калия масса выпавшего осадка оказалась в 2,07 раза больше массы алкена. Установите формулу алкена.
Решение. Алкены окисляются водным раствором перманганата калия по общему уравнению:
ЗСnН2n + 2KМnO4 + 4Н2O = 3CnH2n(OH)2 + 2MnO2↓ + 2KOH.
Из 3 моль алкена (массой 3-(12n+2n) = 42n) образуется 2 моль МnО2 (массой 2*87 = 174 г). По условию задачи
42n –2,07= 174,откуда n = 2. Искомый алкен — этилен. С2Н4. Ответ. С2Н4
Карточка №1
1. Название алкенов по систематической номенклатуре и их общая формула (непредельные углеводороды).
2. Дайте определение непредельным углеводородам и назовите первый представитель их гомологического ряда.
3. Физические свойства и применение непредельных углеводородов и их производных.
Карточка №2
1. Напишите структурные формулы двух гомологов бутена-1и назовите их
2. Дайте названия следующим углеводородам по систематической номенклатуре:
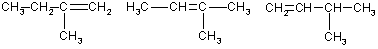
Карточка №3
1. Напишите общую формулу углеводородов гомологического ряда этилена и формулы первых пяти гомолгов. Укажите их названия .
2. Напишите струтурные формулы соединений: 2-метилбутен-1; 3-метилпентен-1; 2-метилгексен-2.
3.Напишите уравнения реакций взаимодействия бутена-1 с водородом, бромом, бромводородом. Какие вещества образовались?
Карточка №4
1. Как получают этилен? Напишите два уравнения соответствующих реакций и укажите условия их протекания.
2. Напишите уравнения реакций: а) пропена-1 с хлороводородом; б) бутена-2 с водородом; в) горения этилена в кислороде; пентана-1 с бромом. Какие вещества образовались?
3. Напишите уравнения реакций при помощи которыхможно осуществиь следующие ревращения: С2Н4 →С2Н6 →С2Н5CL→ С2Н4 →СО2
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
ТАЛДЫКОРГАНСКИЙ КОЛЛЕДЖ СЕРВИСА И ТЕХНОЛОГИИ
ПЛАН ЗАНЯТИЯ №50-51
| Дата | Группа |
| | С11ЭВМ |
| | С11ПУ |
| | СПМ |
| | П11М |
Предмет Химия
Тема занятия «Диеновые углеводороды – Алкадиены», Гомологический ряд, изомеры, химические свойства и получение.
Тип урока Урок сообщений новых знаний
Цель занятия |
систематизировать знания учащихся о периодичности; научить школьников пользоваться Периодической таблицей; сформулировать общие закономерности, лежащие в основе таблицы. |
углеводородов. Дать понятие о свойствах алкадиена. Раскрыть | |
химические свойства диеновых углеводородов. Познакомить | |
учашихся с гомологическим рядом метана. Научить учащихся | |
| состовлять изомеры. | |
| Развивающая: Развивать логическое мышления, умение | |
| пользоваться приемами сравнения и обобщения, выделять | |
| существенное, делать выводы. Продолжить формирование | |
| знаний химического языка и умение его применять при | |
| характеристики химической реакций . | |
| Воспитательная: Воспитывать коллективизм, эстетические | |
нормы, умение высказывать свои взгляды, суждения, | |
понимание значимости обучения, формировать | |
| мировоззренческие понятия о познаваемости природы |
ОБЕСПЕЧЕНИЕ ЗАНЯТИЯ
А. Наглядные пособия Оборудование урока: Презентации-слайды, интерактивная доска.
Б. Раздаточные материалы Н. Н. Нурахметов, К.Бекишев, Н.А.Заграничная Химия 11 класс.
| Содержание этапов урока (основные и необходимые методические пояснение и рекомендации) | ||||||||||||||||||
| I. Организационные вопросы | ||||||||||||||||||
| Организовать группу к занятии. Через дежурных проверить посещаемость | ||||||||||||||||||
| обучающихся. | ||||||||||||||||||
| II. Повторение пройденного материала (Вопрос-ответ) | ||||||||||||||||||
| ||||||||||||||||||
| ||||||||||||||||||
| ||||||||||||||||||
| ||||||||||||||||||
| ||||||||||||||||||
| III. Изложение нового материала | ||||||||||||||||||
| Алкадиены — непредельные углеводороды, содержащие две двойные связи. Общая формула алкадиенов СnН2n-2. Если двойные связи разделены в углеродной цепи двумя или более одинарными связями (например, пентадиен-1,4), то такие двойные связи называются изолированными(одинарными). Двойные связи могут чередоваться, могут располагаться подряд. Если в молекулах алкадиенов двойные связи чередуются одинарными связями, то они называются сопряженными диеновыми углеводородами. СН2 = С= СН –СН3 бутадиен-1,2 СН2 = СН-СН = СН2 бутадиен-1,3(дивинил) СН2 = СН-СН2-СН =СН2 пентадиен-1,4 Для алкадиенов характерны те же виды изомерии, что и для алкенов: 1) изомерия углеродного скелета. 2) изомерия положения двойных связей 3) цис-транс-изомерия Номенклатура. Главную цепь в диенах выбирают так, чтобы она содержала обе двойные связи, и нумеруют с того конца, при котором сумма номеров положений двойных связей минимальна. В названии соответствующего алкана окончание -ан заменяется на -диен. Физические свойства. Бутадиен-1,3 — легко сжижающийся газ с неприятным запахом. Изопрен — жидкость с tкип 34 С. Получение. Основной промышленный способ получения диенов — дегидрирование алканов. Бутадиен-1,3 (дивинил) получают из бутана: СН3-СН2-СН2-СН3 t,Сr2О3→ СН2=СН-СН=СН2 + 2Н2 Бутадиен-1,3 можно также получать по реакции С.В. Лебедева путем одновременного дегидрирования и дегидратации этанола:
Химические свойства. Для алкадиенов характерны обычные реакции электрофильного присоединения АE, свойственные алкенам. Особенность сопряженных диенов состоит в том, что две двойные связи в их молекулах функционируют как единое целое, поэтому реакции присоединения могут протекать в двух направлениях: а) к одной из двойных связей (1,2-присоединение) или б) в крайние положения сопряженной системы с образованием новой двойной связи в центре системы (1,4-присоединение). Так, присоединение брома к бутадиену может привести к двум продуктам:
Или
Важнейшее свойство диенов — их способность к полимеризации, которая используется для получения синтетических каучуков. При бутадиеновый полимеризации бутадиена-1,3, которая протекает как 1,4-присоединение, получают каучук: nСН2=СН-СН=СН2 → (-СН2-СН=СН-СН2-)n. 2.Гидрирование (Присоединение водорода протекает стадийно) СН2 = СН-СН = СН2 +Н2 → Н3С-НС =СН-СН3 бутадиен-1,3(дивинил) Бутен-2 Н3С-НС =СН-СН3 + Н2 → Н3С- Н2С- СН2 -СН3 Бутен-2 Бутан Применение. Основная область применения алкадиенов - синтез каучуков. Вулканизацией называется процесс нагревания каучука с серой, в результате которого получают резину. Впервые эффективный способ получения полибутадиенового каучука был предложен русским химиком С.В.Лебедевым. | ||||||||||||||||||
| ІV. Закреплениев нового материала (выполнение заданий, оценка знаний и др.) | ||||||||||||||||||
| ||||||||||||||||||
| ||||||||||||||||||
| ||||||||||||||||||
| ||||||||||||||||||
| V. Домашнее задание | ||||||||||||||||||
| | ||||||||||||||||||
| Составить 5 формул с изомерами (диеновых СН-ов) Пар. №8 | ||||||||||||||||||
| VI. Подведение итогов урока (Выставление оценок с комментарием, выяснение положительных и отрицательных моментов урока) |
Преподаватель_____________ А.С.Ингенбаева
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
ТАЛДЫКОРГАНСКИЙ КОЛЛЕДЖ СЕРВИСА И ТЕХНОЛОГИИ
ПЛАН ЗАНЯТИЯ №52-53
| Дата | Группа |
| | С11ЭВМ |
| | С11ПУ |
| | СПМ |
| | П11М |
Предмет Химия
Тема занятия «Ацетиленовые углеводороды – Алкины », Гомологический ряд, изомеры, химические свойства и получение.
Тип урока Урок сообщений новых знаний
Цель занятия | Учебная: Раскрыть физические свойства ацетиленовых систематизировать знания учащихся о периодичности; научить школьников пользоваться Периодической таблицей; сформулировать общие закономерности, лежащие в основе таблицы. |
углеводородов. Дать понятие о свойствах алкинов. Раскрыть | |
химические свойства ацетиленовых углеводородов. | |
Познакомить учашихся с гомологическим рядом ацетилена | |
Научить учащихся состовлять изомеры. | |
| Развивающая: Развивать логическое мышления, умение | |
| пользоваться приемами сравнения и обобщения, выделять | |
| существенное, делать выводы. Продолжить формирование | |
| знаний химического языка и умение его применять при | |
| характеристики химической реакций . | |
| Воспитательная: Воспитывать коллективизм, эстетические | |
нормы, умение высказывать свои взгляды, суждения, | |
понимание значимости обучения, формировать | |
| мировоззренческие понятия о познаваемости природы |
ОБЕСПЕЧЕНИЕ ЗАНЯТИЯ
А. Наглядные пособия Оборудование урока: интерактивная доска, презетаций-слайды, видео-лаб.работы
Б. Раздаточные материалы Н. Н. Нурахметов, К.Бекишев, Н.А.Заграничная Химия 11 класс.
| Содержание этапов урока (основные и необходимые методические пояснение и рекомендации) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| I. Организационные вопросы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Организовать группу к занятии. Через дежурных проверить посещаемость | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| обучающихся. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| II. Повторение пройденного материала (Вопрос-ответ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| III. Изложение нового материала | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Алкинами называются непредельные углеводороды, молекулы которых содержат одну тройную связь. Первый представитель этого класса — ацетилен НС ≡ СН, в связи с чем алкины также называют ацетиленовыми углеводородами. Ближайшие гомологи ацетилена:
Простейший алкин с разветвленным углеродным скелетом: З-метилбутин-1 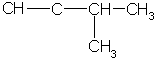 Общая формула гомологического ряда алкинов СnН2n-2. Она совпадает с общей формулой алкадиенов, поэтому алкины и алкадиены являются межклассовыми изомерами. Общая формула гомологического ряда алкинов СnН2n-2. Она совпадает с общей формулой алкадиенов, поэтому алкины и алкадиены являются межклассовыми изомерами. Строение. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации. Две -связи, образованные гибридными орбиталями, располагаются по одной линии под углом 180° друг к другу; две -связи образованы при перекрывании двух пар негибридных 2p-орбиталей соседних атомов углерода. Дополнительное связывание двух атомов углерода приводит к тому, что расстояние между ядрами уменьшается, поскольку тройная связь является сочетанием одной - и двух -связей. Длина тройной связи С ≡ С составляет 0,120 нм, что меньше длины как одинарной, так и двойной связи. Энергия тройной связи составляет 828 кДж/моль. Структурная изомерия алкинов обусловлена изомерией углеродного скелета (например, 3-метилбутин-1 и пентин-1) и изомерией положения тройной связи (бутин-1 и бутин-2). Пространственная изомерия для алкинов не характерна. Номенклатура. В алкинах с неразветвленной углеродной цепью нумерацию начинают с того конца, ближе к которому находится тройная связь. В названии соответствующего алкана окончание -ан заменяется на -ин. В разветвленных алкинах выбирают главную цепь так, чтобы она содержала тройную связь, даже если она при этом и не будет самой длинной. Перед названием главной цепи указывают номер атома углерода, при котором находится заместитель, и название этого заместителя. Номер после названия главной цепи указывает положение тройной связи, например: 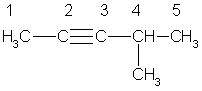 4-метилпентин-2 Физические свойства алкинов похожи на свойства алканов и алкенов. При обычных условиях (С2 – С4) — газы, (C5 – C16) — жидкости, начиная с C17 — твердые вещества. Температуры кипения алкинов выше, чем у соответствующих алкенов. Так, этилен имеет tкип = -103 °С, ацетилен кипит при -83,6 °С; пропен и пропин соответственно при -47 °С и -23 °С. Растворимость низших алкинов в воде несколько выше, чем алкенов и алканов, однако она все же очень мала. Алкины хорошо растворимы в неполярных органических растворителях. Получение: 1.Ацетилен получают в промышленности путем высокотемпературного крекинга метана:
2.В лабораторных условиях ацетилен получают гидролизом карбида кальция: СаС2 + 2Н2О = Са(ОН)2 + С2Н2 ↑ Химические свойства алкинов обусловлены наличием в их молекулах тройной связи. Типичными реакциями для ацетилена и его гомологов являются реакции электрофильного присоединения АE. Отличие алкинов от алкенов заключается в том, что реакции присоединения могут протекать в две стадии. На первой стадии идет присоединение к тройной связи с образованием двойной связи, а на второй стадии — присоединение к двойной связи. Реакции присоединения для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что -электронная плотность тройной связи расположена более компактно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами. 1. Галогенирование. Галогены присоединяются к алкинам в две стадии. Например, присоединение брома к ацетилену приводит к образованию дибромэтена, который, в свою очередь, реагирует с избытком брома с образованием тетрабромэтана:
Алкины, так же, как и алкены, обесцвечивают бромную виду. 2. Гидрогалогенирование. Галогеноводороды присоединяются к тройной связи труднее, чем к двойной. Для активации галогеноводорода используют АlСl3 — сильную кислоту Льюиса. Из ацетилена при этом можно получить винилхлорид (хлорэтен), который используется для получения важного полимера поливинилхлорида.
В случае избытка галогеноводорода происходит полное гидрогалогенирование, причем для несимметричных алкинов на каждой стадии присоединение идет по правилу Марковникова, например:
3. Гидратация. Присоединение воды к алкинам катализируется солями ртути (II)'
На первой стадии реакции образуется непредельный спирт, в котором гидроксильная группа находится непосредственно у атома углерода при двойной связи. Такие спирты принято называть виниловыми или енолами. Отличительной чертой енолов является их неустойчивость. В момент образования они изомеризуются в более стабильные карбонильные соединения (альдегиды или кетоны) за счет переноса протона от гидроксильной группы к соседнему атому углерода при двойной связи. При этом -связь между атомами углерода разрывается, и образуется -связь между атомом углерода и атомом кислорода. Причиной изомеризации является большая прочность двойной связи С = О по сравнению с двойной связью С = С.В результате реакции гидратации только ацетилен превращается в альдегид; гидратация гомологов ацетилена протекает по правилу Марковникова;, и образующиеся енолы изомеризуются в кетоны. Так, например, пропин превращается в ацетон:
Реакция гидратации алкинов была открыта М.Г. Кучеровым (1881 г.) и носит название реакции Кучерова. 4. В обычных условиях Ац.СН-ды только димеризуются и тримеризуются. Винилацетилен обладает большой реакционной способностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука: 2СН –СН → СН2 = СН-С = СН винилацетилен При пропускании ацетилена над активированным углем при 600 °С происходит тримеризация ацетилена с образованием бензола: 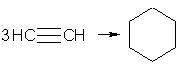 5.Горение (выделяется большое количества тепла): С2Н2+5О2 → 4СО2 +2Н2О+2600кДж Применение. На основе ацетилена развились многие отрасли промышленности органического синтеза. Выше уже отмечена возможность получения уксусного альдегида из ацетилена и различных кетонов из гомологов ацетилена по реакции Кучерова. в свою очередь, большой интерес представляют реакции алкинов с кетонами. Например, реакцией ацетилена с ацетоном можно получить изопрен — исходный продукт для получения синтетического каучука. Хлоропрен также получают из винилаиетилена. Ацетилен используется для сварки (кислородноацетиленовая сварка) металлов, поскольку при его горении развивается высокая температура.Его часто иср. Для сварки и резки металлов. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ІV. Закреплениев нового материала (выполнение заданий, оценка знаний и др.) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| В молекулах ацетиленовых углеводородов имеется тройная связь. Для них характерна реакция присоединения, эта реакция протекает ступенчато. В отличие от других СН-ов атом водорода в ацетилене проявляет кислотные свойства. Ацетилен взаимодействует с измельченными металлами и солями тяжелых металлов и образует ацетилениды. В обычных условиях в реакции полимеризации не вступает, а только димеризуется и тримеризуется | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| V. Домашнее задание | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Составить 5 формул с изомерами (диеновых СН-ов) Пар. №9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| VI. Подведение итогов урока (Выставление оценок с комментарием, выяснение положительных и отрицательных моментов урока) |


