Файл: I. Периодический закон, периодическая система химических элементов в свете теории строения атомов.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 26.04.2024
Просмотров: 271
Скачиваний: 0
СОДЕРЖАНИЕ
Тип урока Комбинированный урок.
Тип урока Лабораторно-практическое занятие. Урок закрепление.
Тип урока Комбинированный урок.
Тип урока Лабораторно-практическое занятие. Урок закрепление
Тема занятия: Понятие о скорости химической реакции. Катализаторы. Химическое равновесие
Тип урока: Урок сообщений новых знаний
Тип урока Комбинированный урок.
Тип урока Лабораторно-практическое занятие. Урок закрепление
Тип урока Урок систематизации и обобшения.
Тип урока Комбинированный урок.
Тип урока Комбинированный урок.
Тип урока Комбинированный урок.
Тип урока Лабораторно-практическое занятие. Урок закрепление
Тип урока Лабораторно-практическое занятие. Урок закрепление
Тип урока Комбинированный урок.
Тип урока Лабораторно-практическое занятие. Урок закрепление
Тип урока Контроль знаний и умений.
Тип урока Урок комбинированный.
Тип урока Урок комбинированный.
Тип урока Урок комбинированный.
Тип урока Урок комбинированный.
Тип урока Урок комбинированный.
Тип урока Лабораторно-практическое занятие. Урок закрепление.
Тема занятий Спирты, классификация. Функциональная группа, ее электронное строение
Тема занятий Многоатомные спирты. Получение и применение
Тема занятий Фенол. Строение, физические и химические свойства
Тема занятий Альдегиды.Состав и строение альдегидов. Хиимические свойства и получение.
Тема занятий Карбоновые кислоты, строение.
Тема занятий Физические и химические свойства карбоновых кислот.
Преподаватель_____________ А.С.Ингенбаева
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
ТАЛДЫКОРГАНСКИЙ КОЛЛЕДЖ СЕРВИСА И ТЕХНОЛОГИИ
ПЛАН ЗАНЯТИЯ №23
| Дата | Группа |
| | С11ЭВМ |
| | С11ПУ |
| | СПМ |
| | П11М |
Предмет Химия
Тема занятия Общая характеристика металлов главной подгруппы ІІ группы. Кальций и магний.
Тип урока Комбинированный урок.
Цель занятия | Учебная: Познакомить учащихся с представителями тизировать знания учащихся о периодичности; научить школьников пользоваться Периодической таблицей; сформулировать общие закономерности, лежащие в основе таблицы. |
соединений металлов Ca и Mg. | |
| Развивающая: Продолжить обучение учащихся пользоваться | |
| периодической системой.Совершенствовать умения | |
| составления уравнений химических реакций. | |
| Воспитательная: Показать значимость химических знаний | |
для современного наукоемкого производства и успешной | |
| адаптации будущих специалистов в современном обществе. |
ОБЕСПЕЧЕНИЕ ЗАНЯТИЯ
А. Наглядные пособия Слайды «Общая характеристика металлов главной подгруппы ІІ группы. Кальций и магний.»
Б. Раздаточные материалы Н. Н. Нурахметов, К.Бекишев, Н.А.Заграничная Химия 10 класс.
| Содержание этапов урока (основные и необходимые методические пояснение и рекомендации) |
| I. Организационные вопросы |
| Организовать группу к занятии. Через дежурных проверить посещаемость |
| обучающихся. |
| II. Повторение пройденного материала (виды контроля знаний) |
| 1. Фронтальная беседа с группой по вопросам. |
| -Дайте сравнительную характеристику калия и натрия -Химические и физические свойства натрия и калия -Получение и применение натрия и калия -Биологическая их роль. |
| III. Изложение нового материала (методика) |
| 1.Раздать краткий курс лекций по теме. 2. Показать слайды и объяснять тему с словесным и деманстрационным методом.3. Записать в тетрадях основные понятия. Общая характеристика металлов главной подгруппы II группы 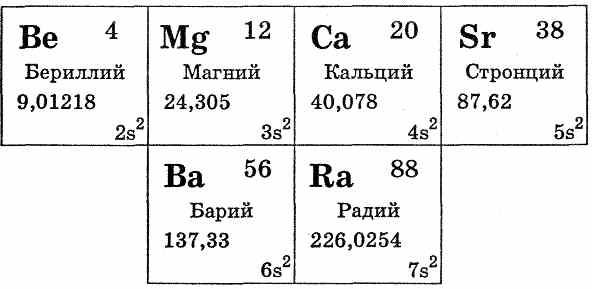 В главную подгруппу II группы входят бериллий Be, магний Mg, кальций Са, стронций Sr, барий Ва, радий Ra. Из них кальций, стронций, барий относятся к семейству щелочноземельных металлов. Это s-элементы. В виде простых веществ типичные металлы. На внешнем уровне имеют по два электрона. Отдавая их, они проявляют в соединениях степень окисления +2. В окислительно-восстановительных реакциях все металлы подгруппы ведут себя как сильные восстановители, однако несколько более слабые, чем щелочные металлы. Это объясняется тем, что атомы металлов II группы имеют меньшие атомные радиусы, чем атомы соответствующих щелочных металлов, расположенных в тех же периодах. Это связано с некоторым сжатием электронных оболочек, так как s-подуровень внешнего электронного слоя у них завершен, поэтому электроны ими удерживаются сильнее. Физические и химические свойства элементов главной подгруппы II группы 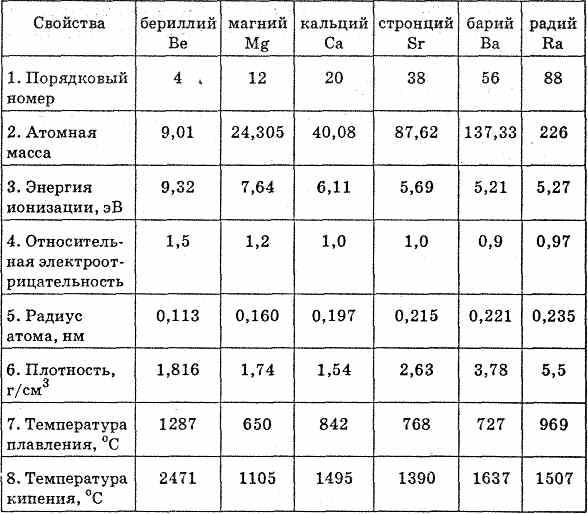 С ростом порядкового номера элемента отдача электронов облегчается, и поэтому металлические свойства закономерно возрастают. Более ярко они проявляются у щелочноземельных металлов. Следует отметить, что по своим свойствам бериллий и магний несколько отличаются от щелочноземельных металлов кальция, стронция и бария (последний элемент группы радий отличается от остальных щелочноземельных металлов природными радиоактивными свойствами). Кальций, стронций и барий окисляются на воздухе до оксидов состава RO, поэтому их хранят без доступа воздуха либо в герметически закрытых сосудах, либо под слоем эфира или керосина. Бериллий и магний при комнатной температуре на воздухе покрываются тонкой оксидной пленкой, предохраняющей их от дальнейшего окисления. Для получения оксидов этих металлов их необходимо поджечь: Be+O2=ВеО Кальций, стронций и барий разлагают воду уже при обычной температуре с образованием соответствующих гидроксидов и выделением водорода: R+2H2O=R(OH)2+H2 Гидроксиды щелочноземельных металлов малорастворимы в воде, их растворимость возрастает от Са(ОН)2 к Ва(ОН)2. Бериллий с водой не взаимодействует, т.к. образующаяся в первый момент пленка малорастворимого гидроксида бериллия Ве(ОН)2 пассивирует металл. Гидроксид бериллия Ве(ОН)2 имеет амфотерный характер: Be2++2ОН-Ве(ОН)2Н2ВеO22Н++BeO2-2 Однако свойства Ве(ОН)2 как основания выражены гораздо отчетливее кислотных. Магний реагирует с водой лишь при нагревании: Mg+2Н2O=Mg(OH)2+H2 Гидроксид магния — типичное основание. При нагревании все металлы главной подгруппы II группы активно реагируют с водородом (давая гидриды RH2, с галогенами, серой, азотом, фосфором, углеродом. Из металлов этой подгруппы наибольшее значение имеют магний и кальций. |
| ІV. Закреплениев нового материала (выполнение заданий, оценка знаний и др.) |
| Выполнение упражнений по учебнику. |
| V. Домашнее задание |
| Учебник Н. Н. Нурахметова «Химия» 10 класс, стр. 159 – 171 прочитать, упр. 3, 4 на стр. 171 выполнить в тетрадях. |
| VI. Подведение итогов урока (Выставление оценок с комментарием, выяснение положительных и отрицательных моментов урока) |
| 1. Выставление оценок с комментарием, |
| 2. Выяснение положительные и отрицательные моментов урока |
Преподаватель_____________ А.С.Ингенбаева
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
ТАЛДЫКОРГАНСКИЙ КОЛЛЕДЖ СЕРВИСА И ТЕХНОЛОГИИ
ПЛАН ЗАНЯТИЯ №23
| Дата | Группа |
| | С11ЭВМ |
| | С11ПУ |
| | СПМ |
| | П11М |
Предмет Химия
Тема занятия Кальций и магний, физические и химические свойства, получение и применение.
Тип урока Комбинированный урок.
Цель занятия | Учебная: Познакомить учащихся с представителями тизировать знания учащихся о периодичности; научить школьников пользоваться Периодической таблицей; сформулировать общие закономерности, лежащие в основе таблицы. |
соединений металлов Ca и Mg. | |
| Развивающая: Продолжить обучение учащихся пользоваться | |
| периодической системой.Совершенствовать умения | |
| составления уравнений химических реакций. | |
| Воспитательная: Показать значимость химических знаний | |
для современного наукоемкого производства и успешной | |
| адаптации будущих специалистов в современном обществе. |
ОБЕСПЕЧЕНИЕ ЗАНЯТИЯ
А. Наглядные пособия Слайды «Кальций и магний, физические и химические свойства, получение и применение.»
Б. Раздаточные материалы Н. Н. Нурахметов, К.Бекишев, Н.А.Заграничная Химия 10 класс.
| Содержание этапов урока (основные и необходимые методические пояснение и рекомендации) |
| I. Организационные вопросы |
| Организовать группу к занятии. Через дежурных проверить посещаемость |
| обучающихся. |
| II. Повторение пройденного материала (виды контроля знаний) |
| 1. Фронтальная беседа с группой по вопросам. |
| - Общая характеристика металлов главной подгруппы ІІ группы. - Дайте сравнительную характеристику кальция и магния. 2. Проверить: упр. 3, 4 на стр. 171 выполненных в тетрадях. |
| III. Изложение нового материала (методика) |
| 1.Раздать краткий курс лекций по теме. 2. Показать слайды и объяснять тему с словесным и деманстрационным методом.3. Записать в тетрадях основные понятия. Физические свойства Кальций – серебристо-белый легкий металл, его плотность (1,55 г/см3) близка к плотности щелочных металлов, однако кальций – более твердый металл, на воздухе кальций быстро покрывается пленкой, его хранят под керосином. Магний – белый металл, на воздухе быстро покрывается оксидной пленкой, поэтому становится матовым. Магний достаточно пластичен, легко поддается прокатке и ковке. Химические свойства По химической активности кальций немного, а магний значительно уступают щелочным металлам. В химических реакциях они – активные восстановители. Уже при обычной температуре они взаимодействуют с галогенами Mg + Cl2 = MgCl2 При нагревании кальций и магний окисляются серой, азотом и другими неметаллами. Ca + S = CaS 3Mg + N2 = Mg3N2 Кальций при нагревании на воздухе загорается, а затем внесенный в чистый кислород горит ярким пламенем с образованием белого дыма – частиц оксида кальция: 2Ca + O2 = 2CaO Если поджечь на воздухе порошок магния или тонкую магниевую пластинку, то горение происходит с ослепительной вспышкой. При нагревании в струе водорода кальций образует гидрид Ca + H2 = CaH2 Магний непосредственно с водородом не взаимодействует. Как и щелочные металлы, кальций бурно реагирует с водой, вытесняя из нее водород Ca + 2HOH = Ca(OH)2 + H2 Mg + H2O = MgO + H2 Металлы кальция и магния могут окисляться водород кислот: Ca + 2HCl = CaCl2 + H2 Благодаря большой химической активности металлический кальций и магний восстанавливают многие металлы из их оксидов и хлоридов: это свойство используется для Ti, Zr, V, U. TiCl4 + 2Mg = Ti + 2MgCl2 Получение Кальций и магний получают в промышленности так же, как и щелочные металлы, - электролизом расплава солей CaCl2 = Ca + Cl2 Применение Легкие и прочные сплавы магния широко применяются в авиации и машиностроении. Это сплавы электрон (Mg, Al, Zn, Mn), магналит. Добавка магния в чугун придает ему такиесвойста, как ковкость и прочность. Кальций также применяют для получения сплавов, например высокосортной стали. Сплавы кальция и свинца используются в производстве подшипников. Магниевые пластины используются в качестве протектора для защиты от коррозии кораблей и трубопроводов. Важнейшие соединения. Оксид кальция – белое тугоплавкое вещество. В технике CaO - называют негашеной известью. Получают при прокаливании известняка CaCO3 = CaO + CO2 Гидроксид кальция – малорастворим в воде, его насыщенный раствор часто используют в лабораториях под названием известковая вода. Щелочной раствор обнаруживается по окраске малиновой. В технике называют Ca(OH)2 – известковым молоком. Оксид магния MgO– (магнезия) – легкий, рыхлый порошок, белого цвета, легко впитывает воду. На этом свойстве основано применение в спортивной гимнастике. Нанесенный на ладони спортсмена порошок предохраняет его от опасности сорваться с гимнастического снаряда. Природные карбонаты магния – магнезит и доломит – широко применяется для изготовления огнеупорных и строительных материалов |
| ІV. Закреплениев нового материала (выполнение заданий, оценка знаний и др.) |
| Выполнение упражнений по учебнику. |
| V. Домашнее задание |
| Учебник Н. Н. Нурахметова «Химия» 10 класс, стр. 159 – 171 прочитать, упр. 7, 9 на стр. 171 выполнить в тетрадях. |
| VI. Подведение итогов урока (Выставление оценок с комментарием, выяснение положительных и отрицательных моментов урока) |
| 1. Выставление оценок с комментарием, |
| 2. Выяснение положительные и отрицательные моментов урока |
Преподаватель_____________ А.С.Ингенбаева
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
ТАЛДЫКОРГАНСКИЙ КОЛЛЕДЖ СЕРВИСА И ТЕХНОЛОГИИ
ПЛАН ЗАНЯТИЯ №24
| Дата | Группа |
| | С11ЭВМ |
| | С11ПУ |
| | СПМ |
| | П11М |
Предмет Химия
Тема занятие Практическая работа №4. «Знакомство с образцами важнейших солей натрия, калия и магния.
Тип урока Лабораторно-практическое занятие. Урок закрепление
Цель занятия | Учебная: Знать химические свойства металлов, неметаллов и |
| амфотерных элементов. | |
Развивающая: Уметь практический доказывать свойства | |
элементов характерными реакциями. Уметь составлять | |
уравнения реакций, доказывающие свойства металлов, | |
| амфотерных элементов, соблюдать правила по технике | |
безопасности при работе в кабинете химии. | |
| Воспитательная: воспитывать обучающихся работать | |
группой, организованности, уметь пользоваться таблицами. |
ОБЕСПЕЧЕНИЕ ЗАНЯТИЯ
А. Наглядные пособия Видеоопыты «Химические свойства типичных металлов, неметаллов и амфотерных элементов».
Б. Раздаточные материалы Н. Н. Нурахметов, К.Бекишев, Н.А.Заграничная Химия 10 класс, инструкции к выполнению практических работ.
| Содержание этапов урока (основные и необходимые методические пояснение и рекомендации) | |||||||||
| I. Организационные вопросы | |||||||||
| Организовать группу к занятии. Через дежурных проверить посещаемость | |||||||||
| обучающихся. | |||||||||
| II. Повторение пройденного материала (виды контроля знаний) | |||||||||
| 1. Фронтальная беседа с группой по вопросам. | |||||||||
| - Какие химические свойства характерны для металлов? | |||||||||
| - Какие химические свойства характерны для амфотерным элементам? | |||||||||
| - - Какие химические свойства характерны для неметаллов? | |||||||||
| III. Изложение нового материала (методика) | |||||||||
- Какие реактивы и оборудования нам нужны для выполнения этой работы? - Как мы будем делать эту работу? 2. Показать видеофильм «Химические свойства типичных металлов, неметаллов и амфотерных элементов».3. Оформить практическую работу и сделать соответствующие выводы. Практическая работа №3 «Химические свойства типичных натрия ,калия и магния ». Цель работы: Знать химические свойства типичных металлов, неметаллов и амфотерных элементов.Уметь практический доказывать свойства типичных металлов, неметаллов и амфотерных элементов характерными реакциями, проводить наблюдения, делать выводы соблюдать правила по технике безопасности при работе в кабинете химии. Реактивы: стружки магния, растворы серной кислоты и гидроксида натрия, разбавленные и концентрированные серные и азотные кислоты, гранулы алюминия. Оборудование: пробирки, спиртовка, спички. Примечание: Серной и азотной кислотой, щелочами надо работать очень в осторожно! Алгоритм проведения работы: І. Взаимодействие магния с кислотами и щелочами. 1. В две пробирки поместили стружки магния. В одну пробирку добавьте 10 капель 1М раствора серной кислоты, а в другую - 10 капель 1М раствора гидроксида натрия. Запись наблюдений и результатов опыта. 1.Запишите наблюдения. 2. Напишите уравнения протекающих реакций. 3. Запишите уравнения реакций взаимодействия магния с разбавленным и концентрированным раствором серной кислоты. Расставьте коэффициенты методом электронного баланса. ІІ. Взаимодействие алюминия с кислотами и щелочами. 1. Налейте в одну пробирку 10 капель 1М раствора серной кислоты, а во вторую - 10 капель 1М раствора гидроксида натрия. Опустите в них по грануле алюминия. Запись наблюдений и результатов опыта. 1.Запишите наблюдения. 2. Напишите уравнения протекающих реакций. 3. Запишите уравнения реакций взаимодействия алюминия с разбавленной азотной кислотой. Расставьте коэффициенты методом электронного баланса. Заключение: Обратите внимание на изменения, происходящие во всех этапах работы. Ход работы:
| |||||||||
| ІV. Закрепление нового материала (выполнение заданий, оценка знаний и др.) | |||||||||
| 1. Выполнение упражнении по учебнику. | |||||||||
| 2. Решение задач. | |||||||||
| V. Домашнее задание | |||||||||
| Учебник Н. Н. Нурахметова «Химия» 10 класс, подготовиться к | |||||||||
| контрольной работе по теме «Общие свойства металлов и неметаллов». | |||||||||
| VI. Подведение итогов урока (Выставление оценок с комментарием, выяснение положительных и отрицательных моментов урока) | |||||||||
| 1. Выставление оценок с комментарием, | |||||||||
| 2. Выяснение положительные и отрицательные моментов урока |
Преподаватель_____________ А.С.Ингенбаева
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
ТАЛДЫКОРГАНСКИЙ КОЛЛЕДЖ СЕРВИСА И ТЕХНОЛОГИИ
ПЛАН ЗАНЯТИЯ №24
| Дата | Группа |
| | С11ЭВМ |
| | С11ПУ |
| | СПМ |
| | П11М |
Предмет Химия
Тема занятия Практическая работа №4. «Ознакомление с образцами важнейших солей натрия, калия, кальция и магния, сравнение химической активности металлов».
Тип урока Лабораторно-практическое занятие. Урок закрепление
Цель занятия | Учебная: Знать физические свойства, получение и металлов, неметаллов и |
| нахождение солей металлов. | |
Развивающая: Уметь практически доказывать свойства | |
металлов характерными реакциями. Уметь составлять | |
уравнения реакций, доказывающие получение металлов, | |
| соблюдать правила по технике безопасности при работе | |
в кабинете химии. | |
| Воспитательная: воспитывать обучающихся работать | |
группой, организованности, уметь пользоваться таблицами. |
ОБЕСПЕЧЕНИЕ ЗАНЯТИЯ
А. Наглядные пособия Видео «Ознакомление с образцами важнейших солей натрия, калия, кальция и магния, сравнение химической активности металлов».
Б. Раздаточные материалы Н. Н. Нурахметов, К.Бекишев, Н.А.Заграничная Химия 10 класс, инструкции к выполнению практических работ.
| Содержание этапов урока (основные и необходимые методические пояснение и рекомендации) | ||||||||||
| I. Организационные вопросы | ||||||||||
| Организовать группу к занятии. Через дежурных проверить посещаемость | ||||||||||
| обучающихся. | ||||||||||
| II. Повторение пройденного материала (виды контроля знаний) | ||||||||||
| 1. Фронтальная беседа с группой по вопросам. | ||||||||||
| - Какие химические элементы относятся металлам? | ||||||||||
| - Какие элементы І группы Вы знаете? | ||||||||||
| - Какие элементы ІІ группы Вы знаете? | ||||||||||
| III. Изложение нового материала (методика) | ||||||||||
- Какие реактивы и оборудования нам нужны для выполнения этой работы? - Как мы будем делать эту работу? 2. Показать видео «Ознакомление с образцами важнейших солей натрия, калия, кальция и магния, сравнение химической активности металлов».3. Оформить практическую работу и сделать соответствующие выводы. Практическая работа №4 «Ознакомление с образцами важнейших солей натрия, калия, кальция и магния, сравнение химической активности металлов». Цель работы: Знать физические свойства металлов, нахождение и получение солей металлов.Уметь практический доказывать свойства солей металлов характерными реакциями, проводить наблюдения, делать выводы соблюдать правила по технике безопасности при работе в кабинете химии. Реактивы: коллекция «образцы важнейших солей натрия, калия, кальция и магния». Оборудование: Карта Казахстана, учебник химии 10 класс. Алгоритм проведения работы: Задание. Ознакомитесь с выданными образцами важнейших солей натрия, калия, кальция и магния и заполните таблицу.
| ||||||||||
| ІV. Закрепление нового материала (выполнение заданий, оценка знаний и др.) | ||||||||||
| 1.Выполнение упражнении по учебнику. | ||||||||||
| 2.Решение задач. | ||||||||||
| V. Домашнее задание | ||||||||||
| Учебник Н. Н. Нурахметова «Химия» 10 класс, подготовиться к | ||||||||||
| практической работе №6. «Решение экспериментальных задач по теме: «Металлы главных подгрупп». на стр.167. | ||||||||||
| VI. Подведение итогов урока (Выставление оценок с комментарием, выяснение положительных и отрицательных моментов урока) | ||||||||||
| 1. Выставление оценок с комментарием, | ||||||||||
| 2. Выяснение положительные и отрицательные моментов урока |

