Файл: 1. Критерии диагностики инфекционных заболеваний. 4 Основные направления терапии инфекционных больных. 5.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.03.2024
Просмотров: 200
Скачиваний: 0
СОДЕРЖАНИЕ
1. Критерии диагностики инфекционных заболеваний.
2. Основные направления терапии инфекционных больных.
5. Эшерихиозы. Этиология, эпидемиология, патогенез, клиника, лечение.
8. Лечение больных сальмонеллезом и пищевыми токсикоинфекциями. Принципы регидратации.
10. Вирусные гастроэнтериты. Этиология, эпидемиология, клиника, лечение.
23. Аденовирусная инфекция. Этиология. Особенности эпидемиологии. Клинические формы. Лечение.
24. Респираторно-синцитиальная инфекция. Этиология, эпидемиология. Клинические формы. Лечение.
26. Лечение и профилактика новой коронавирусной инфекции.
28. Менингококцемия. Этиология, патогенез, клиника, осложнения, лечение, прогноз.
33. Сепсис. Определение. Этиология, патогенез, клиника, принципы лечения.
34. Сибирская язва. Этиология, эпидемиология, патогенез, клиника, лечение.
Тактика врача при подозрении на особо опасные инфекции
37. Столбняк. Этиология, эпидемиология, патогенез, клиника, лечение.
38. Рожа. Этиология, патогенез, клиника, лечение, профилактика.
39. ВИЧ-инфекция. Этиология, патогенез, характер иммунных нарушений.
43. Герпетическая инфекция. Простой герпес.
44. Ветряная оспа, опоясывающий лишай.
47. Диагностический поиск при ОКИ
48. Диагностический поиск при поражениях печени различной этиологии.
49. Оспа обезьян. Этиология, эпидемиология, патогенез, клинические формы, лечение, профилакт.
ПАТОГЕНЕЗ Дифференцировочный антиген CD4+ (CD - аббревиатура от Cell Differention antigen) и неспецифические (независящие от наличия CD4+) компоненты - рецепторы для ВИЧ. CD4+ - гликопротеид с молекулярной массой 55 000 кД, по своему строению схожий с определенными участками Ig. Аналогичное строение имеет и белок вируса gp120; это и определяет способность проникновения вирионов в клетку. Рецептор CD4+ , расположенный на мембране иммунокомпетентных клеток, выполняет функцию распознавания антигенов (вместе с белками HLA - главного комплекса гистосовместимости II класса). В организме человека существует целый ряд иммунокомпетентных, соматических и др клеток, несущих рецепторы для ВИЧ (табл. 21.9).

Оболочка ВИЧ содержит белки человеческого комплекса гистосовместимости I и II классов, поэтому проникновение вируса в организм не вызывает реакции 675 отторжения. Фиксация вирионов на поверхности клетки-мишени происходит при участии гликопротеина gp120. Гликопротеин gp41 обеспечивает слияние вирусной оболочки с мембраной клетки-мишени. Двухцепочечная РНК вируса проникает в клетку, где с помощью обратной транскриптазы происходит синтез одноцепочечной провирусной ДНК. Затем происходит формирование двухце-почечной ДНК, встраивающейся в ДНК клетки с помощью интегразы. Вирусная ДНК выполняет функцию матрицы для синтеза РНК, собирающей новую вирусную частицу. Нередко при репликации ВИЧ возникают генетические ошибки. Таким образом происходит образование разных подтипов вируса. После проникновения ВИЧ в СD4+-клетки начинается его репликация: чем активнее CD4+-клетки, тем интенсивнее репродукция вируса. Поэтому регуляторы, активирующие СD4+-клетки, обеспечивают увеличение репликации вируса. К подобным регуляторам относят ФНО; фактор, стимулирующий колонии гранулоцитов и макрофагов (колониестимулирующий фактор) и ИЛ-6. ИФН и трансформирующий фактор роста - регуляторы
, тормозящие репликацию вируса. Как показали исследования, ФНО-α активирует транскрипцию провирусной ДНК ВИЧ-1 в хронически инфицированных Т-клетках и макрофагах. Моноциты, синтезирующие ФНО-α, не только индуцируют экспрессию ВИЧ-инфицированными клетками, но и стимулируют активацию латентного провируса. Регистрируют одновременную активность ФНО-α, ИЛ-6 и фактора, стимулирующего колонии гранулоцитов и макрофагов. Иммунопатогенетические признаки ВИЧ-инфекции - дефицит Т-звена и В-звена иммунной системы; недостаток компонентов комплемента и фагоцитов; ↓ функций неспецифических факторов защиты. Поликлональная активация Влимфоцитов приводит, с одной стороны, к гипергаммаглобулинемии, а с другой - к ослаблению способности клеток продуцировать вируснейтрализую-щие антитела. Происходит увеличение количества ЦИК и образование антител к лимфоцитам; это вызывает еще большее уменьшение числа CD4+-Т-лимфоцитов. Отмечают развитие аутоиммунных процессов. Поражение иммунной системы при ВИЧ-инфекции носит системный характер. Наряду с дефицитом CD4+-лимфоцитов в течение болезни нарастает функциональная недостаточность СD8+-лимфоцитов, NK-клеток (естественных киллеров) и нейтрофилов. При ухудшении иммунного статуса развиваются различные инфекционные, аллергические, аутоиммунные и лимфопролиферативные заболевания, а также синдром, свойственный болезни иммунных комплексов (эти факторы определяют клиническую картину ВИЧ-инфекции). На начальных стадиях заболевания в организме вырабатываются вируснейтрализующие антитела, подавляющие активность свободно циркулирующих вирусов. Однако такие антитела не действуют на вирусы, находящиеся в клетках (провирусы). С течением времени (обычно после 5-6 лет) происходит истощение защитных возможностей иммунной системы и, следовательно, накопление вируса в крови.
40. Показания к назначению ВААРТ пациентам с ВИЧ-инфекцией. Характеристика препаратов. Назначаемые схемы терапии.
Факторы, учитываемые при решении вопроса о назначении антиретровирусных препаратов. • Степень иммунодефицита (оценивают на основании количества CD4+-лимфоцитов). • Риск прогрессирования болезни (определяют по уровню РНК ВИЧ в крови). • Готовность и желание пациента начать лечение. • Возраст пациента. • Наличие ко-инфекции ВИЧ/ХГВ и/или ВИЧ/ХГС. • Наличие вторичных и сопутствующих заболеваний, нефропатии. • Эпидемиологические особенности (дискордантная пара, подготовка пациента к применению вспомогательных репродуктивных технологий). • Осведомленность пациента о возможных побочных эффектах препаратов и об изменении качества жизни. • Выбор стартовой терапии для достижения стойкого вирусологического ответа и сохранение максимального выбора комбинаций препаратов для последующего использования. • Фармакоэкономическая целесообразность выбора различных схем антивирусной терапии (АРВТ). Для начала АРВТ существуют определенные показания. Разработаны различные схемы применения препаратов (схемы 1-го, 2-го и 3-го ряда), составленные с учетом проведенных клинических исследований эффективности антиретровирусных препаратов (АРВП) (табл. 21.11, 21.12). Таблица 21.11. Показания к проведению АРВТ (при уровне доказательной базы < AI решение о необходимости назначения АРВт принимают коллегиально) в странах с умеренным климатом регистрируют преимущественно в животноводческих регионах в период с апреля по ноябрь, 88% случаев заболевания приходится на июнь-сентябрь.
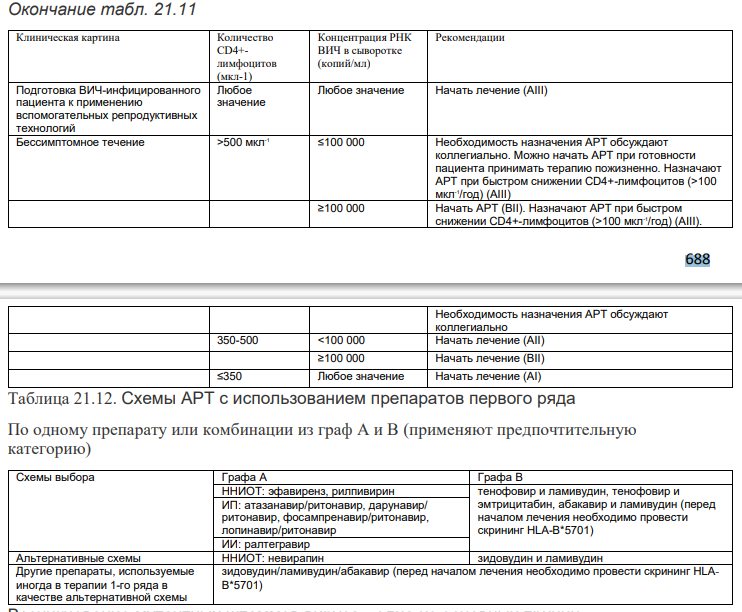
Возникновение мутантных штаммов вируса - одна из основных причин вирусологической неудачи АРВТ. Принципы изменения режима АРВТ при неэффективности схемы первого ряда Наиболее важными принципами выбора препаратов для новой схемы АРВТ при вирусологической неэффективности текущей схемы АРВТ являются следующие: проводить смену АРВТ по результатам теста на резистентность (AII); при наличии возможностей осуществлять замену препаратов внутри фармакологических групп (А11); включать в схему по крайней мере 2, а лучше 3 АРВП (принадлежащих к >2 фармакологическим группам), которые обладают активностью против данной популяции вируса по результатам проведенных тестов на резистентность; ^ при оценке резистентных свойств вируса следует учитывать результаты всех тестов на резистентность и сведения обо всех принимавшихся ранее АРВП; устранить факторы, препятствовавшие адекватному
ответу на прежнюю или текущую схему терапии; менять схему терапии по причине вирусологической неэффективности следует как можно быстрее во избежание накопления дополнительных мутаций резистентности, сужающих спектр активных АРВП для применения в будущем. Исключения составляют ламивудин и эмтрицитабин; не прерывать АРВТ за исключением случаев тяжелых побочных эффектов; если АРВТ прервана, тест на резистентность назначается не позднее 2 нед перерыва; не ограничиваться добавлением еще одного АРВП к неэффективной схеме АРВТ. Схемы лечения пациентов с множественной резистентностью к АРВП Множественная резистентность к АРВП - это наличие резистентности к препаратам различных фармакологических групп. Лечение пациентов с таким видом резистентности представляет наиболее сложную задачу, требует ↑ внимания врача. Даже при правильно интерпретированных результатах исследования резистентности вируса только опытный специалист по лечению ВИЧинфекции должен начинать, прекращать или менять АРВТ. Рекомендуется следующее. • Индивидуальный режим наблюдения, более частый клинический и лабораторный мониторинг (BIII). 690 • Назначение препаратов в соответствии с исследованием профиля резистентности вируса методом секвенирования генома. • Для лечения больных с множественной резистентностью к АРВП возможно назначение в одной схеме ИП и ННИОТ; ИП, ННИОТ и ИИ; двух ИП с соответствующей коррекцией доз. • С учетом наименьшего риска мутаций в схемах лечения таких больных - дарунавир/ритонавир в дозировке 600/100 мг 2 р/сут (BII). • В схемах лечения используются ингибиторы интегразы, ингибиторы слияния, АР. • В целях быстрого подавления вирусной нагрузки рекомендуется введение в схему энфувиртида в качестве 3-го или 4-го компонента. По достижении вирусологической и иммунологической эффективности проводится переключение с энфувиртида на ралтегравир. • Симплификация схем лечения больным, у которых была зафиксирована резистентность к антивирусным препаратам, не допускается. Принцип подхода к лечению пациентов с ВИЧ-инфекцией - пожизненное применение антиретровирусных препаратов. Патогенетическая
терапия и схемы лечения вторичных заболеваний, наиболее часто регистрируемых у ВИЧ-инфицированных пациентов При лечении больных ВИЧ-инфекцией немаловажную роль играет терапия вторичных и сопутствующих заболеваний. В большинстве случаев лечение таких болезней имеет приоритет перед началом АРВТ, поскольку тяжесть состояния пациента определяет наличие той или иной нозологии.

